Искусственный рецептор
Живые клетки умеют удивительно точно распознавать внешние регуляторные сигналы и адекватно реагировать на них. Сигналы могут приходить, например, в виде химических соединений (гормонов, факторов роста, токсинов). В этом случае клетка распознает даже малые их количества при помощи специальных белков-рецепторов, расположенных во внешней (плазматической) мембране. Распознав сигнал, рецепторы передают информацию внутрь клетки, где она многократно усиливается и приводит к тому или иному клеточному ответу. Ничего удивительного, что нанотехнологи неравнодушны к клеточным рецепторам
Самое многочисленное семейство рецепторов – рецепторы, связанные с G-белками, или GPCR (G-protein-coupled receptors). Они умеют распознавать широкий спектр химических соединений, в том числе многие лекарства, наркотики и яды (именно благодаря такому узнаванию эти вещества оказывают свой эффект на организм). Однако после распознавания лиганда GPCR передают сигнал в форме, удобной лишь для живой клетки, и совершенно не удобной для исследователей – в виде активированных G-белков.
В этом смысле более удобны ионные каналы (это тоже белки). Они пронизывают клеточную мембрану насквозь и могут либо пропускать, либо не пропускать сквозь нее те или иные ионы. Открытое или закрытое состояние канала напрямую связано с потенциалом на мембране, который можно измерить.
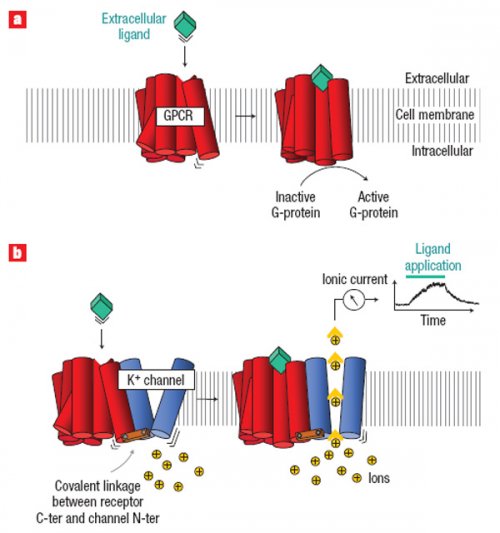 Рисунок 1. Принцип работы химерного рецептора, связанного с ионным каналом. А. Природный трансмембранный GPCR связывает лиганд снаружи клетки, и это приводит к изменению его конформации и активации G-белка внутри клетки. B. В созданном ICCR связывание лиганда приводит к точно таким же изменениям в рецепторе, однако теперь благодаря этому открывается калиевый канал
Рисунок 1. Принцип работы химерного рецептора, связанного с ионным каналом. А. Природный трансмембранный GPCR связывает лиганд снаружи клетки, и это приводит к изменению его конформации и активации G-белка внутри клетки. B. В созданном ICCR связывание лиганда приводит к точно таким же изменениям в рецепторе, однако теперь благодаря этому открывается калиевый канал
Французские ученые решили совместить GPCR и АТФ-зависимый калиевый канал (рисунок 1). Полученную конструкцию назвали ICCR: ion-channel-coupled receptor; рецептор, связанный с ионным каналом. В качестве лиганд-узнающей части взяли человеческий GPCR M2, природным лигандом которого является ацетилхолин, а антагонистом – атропин. Ту часть M2, которая в норме связана с G-белком, отрезали. Вместо нее к белку «пришили» часть АТФ-зависимого калиевого канала, которая является собственно ионным каналом (регуляторную субъединицу при этом выбросили совсем). Теперь этот ионный канал должен был стать не АТФ-зависимым, а ацетилхолин/атропин-зависимым.
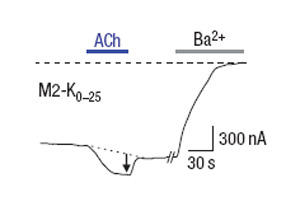 Рисунок 2. Добавление ацетилхолина ACh приводит к открыванию калиевых каналов. Добавление бария блокирует калиевые каналы, как и должно быть
Рисунок 2. Добавление ацетилхолина ACh приводит к открыванию калиевых каналов. Добавление бария блокирует калиевые каналы, как и должно быть
Исследователи продуцировали химерный рецептор в клетках лягушки. Как видно из рисунка 2, добавление ацетилхолина действительно приводило к открыванию калиевых каналов. В то же время атропин действовал противоположным образом: M2 (по всей видимости) переходил в неактивную форму, и калиевые каналы закрывались (рисунок 3).
Таким образом, в полученном ICCR калиевый канал является электрическим детектором активности рецептора M2 – что, несомненно, открывает замечательные перспективы. Благодаря разработанному рецептору можно исследовать влияние различных агонистов и антагонистов ацетилхолина на активность рецептора M2, то есть изучать и предсказывать их физиологическое действие. Напрямую преобразуя химическую информацию в электрический сигнал, ICCR является наглядной демонстрацией возможностей биоподражательной нанотехнологии.
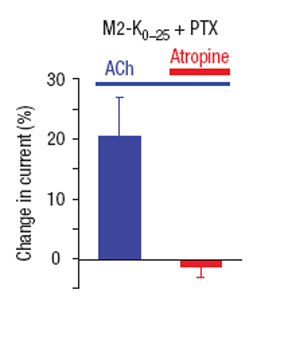 Рисунок 3. Противонаправленное действие ацетилхолина и атропина
Рисунок 3. Противонаправленное действие ацетилхолина и атропина
Работа «Coupling ion channels to receptors for biomolecule sensing» опубликована в Nature Nanotechnology. Авторы, тем временем, не намерены останавливаться на одном частном случае GPCR. Они говорят о возможности создания библиотек всевозможных GPCR, связанных с ионными каналами, которые будут пригодны для диагностических целей, поиска лекарств и создания систем детектирования.
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России