Новая самоорганизующаяся наносистема для адресного лечения рака
За последние несколько лет значительно усилилось внимание к так называемым «адресным» наночастицам, которыми можно управлять с помощью различных по своей природе сигналов, источники которых находятся вне организма пациента. Особое внимание ученых и инженеров в качестве такого сигнала привлекает к себе свет ближнего инфракрасный диапазона (near-infrared (NIR) light) как идеальный инструмент для манипулирования наночастицами.
Ближний инфракрасный свет минимально поглощается кожей и нижележащими тканями, обладает способностью глубоко проникать в ткани, не нанося им вреда, и его энергия может быть преобразована в тепло, нагревающее наночастицы золота. Нагретые наночастицы можно использовать для эффективного радикального удаления пораженной ткани.
В новой статье, опубликованной он-лайн в журнале Angewandte Chemie International Edition, ученые клиники Женская больница Бригэма (Brigham and Women's Hospital, BWH), описывают конструкцию и эффективность первых в своем роде самоорганизующихся многофункциональных NIR-чувствительных наностержней из золота, способных доставлять в раковые клетки специфический химиотерапевтический препарат и селективно высвобождать его в ответ на направленный извне световой луч. Синергическая термохимическая противоопухолевая активность такой системы опосредована теплом, создаваемым световым пучком.
«Дизайн этого золотого наностержня и принцип его самосборки нам подсказала природа и способность комплементарных цепочек ДНК к самостоятельной гибридизации без воздействия на них сложными химическими процессами», – поясняет руководитель исследования директор лаборатории наномедицины и биоматериалов (Laboratory of Nanomedicine and Biomaterials) BWH Омид Фарохзад (Omid Farokhzad), MD. «Каждая функционализированная цепочка ДНК в отдельности и самоорганизующиеся компоненты как система играют разные, но интегративные роли, создавая в результате синергическую таргетную «включаемую» термохимиотерапию, радикально удалявшую опухоли в наших доклинических моделях».
Одна из двух цепочек ДНК связана с наностержнем, а комплементарная ей – со скрытым слоем и молекулой для «самонаведения», которая держит всю систему вне поля видимости иммунной системы, одновременно ориентируя ее непосредственно на раковые клетки. Когда цепочки ДНК соединяются, образуется обладающий адресностью наностержень, а двухцепочечная ДНК служит каркасом для связывания химиотерапевтического препарата (доксорубицина), который высвобождается в ответ на ближний инфракрасный свет, одновременно вызывающий генерацию тепла золотыми наностержнями.
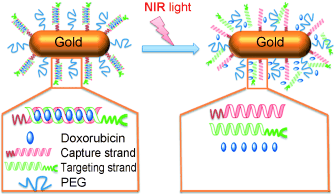 Основанная на способности ДНК к гибридизации, чувствительная к ближнему инфракрасному свету система адресной доставки лекарственных
Основанная на способности ДНК к гибридизации, чувствительная к ближнему инфракрасному свету система адресной доставки лекарственных
препаратов разработана на основе самосборки ДНК. Эта платформа способна высвобождать терапевтические препараты при облучении
ближним инфракрасным светом и демонстрирует высокую эффективность in vivo и in vitro.
(Рис.10.1002/anie.201204018)
«Новая платформа состоит из трех отдельных функциональных компонентов, и каждый играет свою роль в тройном ударе – инициируемой термотерапии, контролируемом высвобождении доксорубицина и таргетинге раковых клеток», – поясняет ведущий автор исследования Чжейу Сяо (Zeyu Xiao).
Чтобы продемонстрировать надежность своей системы, доктор Фарохзад и его коллеги оценили ее противоопухолевую эффективность in vivo на двух различных опухолевых моделях. Через 10 минут после введения наночастиц ученые облучали опухоли ближним инфракрасным светом, который за счет наностержней активировал наночастицы и генерировал тепло. Результаты экспериментов показали, что новая самоорганизующаяся платформа успешно доставляет противораковые препараты и нагревает опухолевую ткань и радикально разрушает новообразования за счет синергического эффекта.
«Тепловая абляции уже широко используется в лечении рака», – комментирует свою разработку доктор Фарохзад. «Что касается этой платформы, она особенно интересна способностью селективно взаимодействовать с раковыми клетками и двойным ударом по опухоли – сначала контролируемым высвобождением химиотерапевтического препарата, а затем инициируемой индукцией тепла в результате активации золотых наностержней. И все это можно сделать неинвазивно».
Несмотря на успешность экспериментов, ученые признают, что до тестирования новой системы доставки на безопасность и эффективность в клинических испытаниях необходимы дополнительные исследования на других доклинических моделях.
Аннотация к статье
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России