Минимальное число молекул
Друзья, с момента основания проекта прошло уже 20 лет и мы рады сообщать вам, что сайт, наконец, переехали на новую платформу.
Какое-то время продолжим трудится на общее благо по адресу
На новой платформе мы уделили особое внимание удобству поиска материалов.
Особенно рекомендуем познакомиться с работой рубрикатора.
Спасибо, ждём вас на N-N-N.ru
Все мы много раз слышали об уникальных свойствах воды. Если бы «жидкость без цвета и запаха» не обладала особыми качествами, жизнь на Земле в ее нынешнем виде была бы невозможна. То же самое можно сказать о твердой форме воды – льде. Теперь ученые выяснили еще один его секрет: в только что опубликованном исследовании специалисты, наконец, определили, сколько именно молекул нужно для того, чтобы получить кристаллик льда (об этом мы уже писали вкратце).
Уникальная связь
Перечислять удивительные свойства воды можно очень долго. Она обладает самой высокой удельной теплоемкостью среди жидкостей и твердых тел, плотность ее кристаллической формы – то есть льда – меньше, чем плотность воды в жидком состоянии, способность к адгезии («прилипанию»), высокое поверхностное натяжение – все это и многое другое позволяет существовать на Земле жизни как таковой.
Своей уникальностью вода обязана водородным связям, точнее их количеству. С их помощью одна молекула H2O может «связаться» с четырьмя другими молекулами. Такие «контакты» ощутимо менее прочны, чем ковалентные связи (разновидность «обычных» связей, которые удерживают вместе, например, атомы водорода и кислорода в молекуле воды), и разорвать каждую водородную связь по отдельности достаточно просто. Но в воде таких взаимодействий очень много, и вместе они заметно ограничивают свободу молекул H2O, не давая им слишком уж легко отрываться от «товарищей», скажем, при нагревании.
Каждая из водородных связей сама по себе существует ничтожную долю секунды – они постоянно разрушаются и возникают вновь. Но при этом в любой момент большая часть молекул воды оказывается вовлечена во взаимодействие с «соседями».
 Рис. 1. Айсберг в море Лазарева у
Рис. 1. Айсберг в море Лазарева у
берегов Антарктиды. Фото РИА Новости,
Алексей Никольский.
Водородные связи несут ответственность и за необычное поведение воды при кристаллизации, то есть при образовании льда. Плавающие по поверхности океана айсберги, корка льда в пресных водоемах – все эти явления нас не удивляют, потому что мы привыкли к ним с рождения. Но если бы основной на Земле была не вода, а какая-нибудь другая жидкость, то ни катков, ни подледной рыбалки не существовало бы вовсе. Плотность практически всех веществ при переходе из жидкого состояния в твердое увеличивается, потому что молекулы теснее «прижимаются» друг к другу, а значит, на единицу объема их становится больше.
Иначе обстоят дела с водой. До температуры в 4 градуса Цельсия плотность H2O дисциплинированно растет, но при переходе этой границы скачкообразно падает на 8 процентов. Объем замерзшей воды, соответственно, увеличивается. С этой особенностью хорошо знакомы жители домов с давно не ремонтировавшимися трубами или те, кто забывал в морозилке слабоалкогольные напитки.
Причина аномального изменения плотности воды при переходе из жидкого состояния в твердое кроется все в тех же водородных связях. Кристаллическая решетка льда напоминает пчелиные соты, в шести углах которых располагаются молекулы воды. Они соединены между собой водородными связями, а их длина превышает длину «обычной» ковалентной связи. В итоге между молекулами затвердевшей H2O оказывается больше пустого пространства, чем было между ними в жидком состоянии, когда частицы свободно перемещались и могли подходить друг к другу совсем близко. Наглядное сопоставление укладок молекул жидкой и твердой фаз воды приведено на следующей картинке.
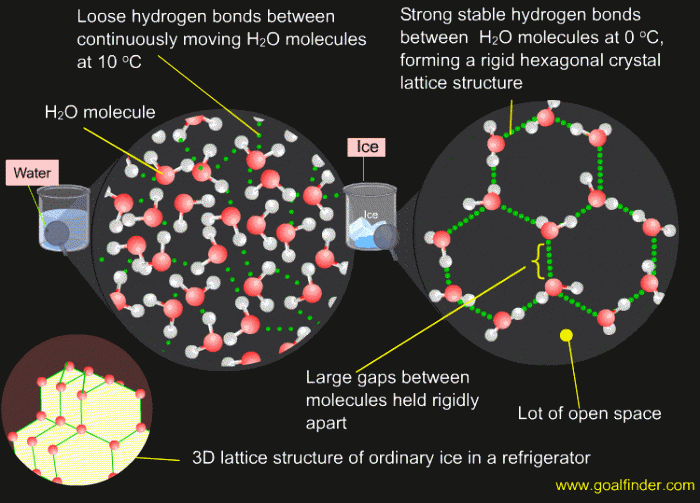 Рис. 2. Взаимная ориентация молекул воды в жидкой и твердой фазе.
Рис. 2. Взаимная ориентация молекул воды в жидкой и твердой фазе.
Исключительные свойства и особая важность воды для обитателей Земли обеспечили ей постоянное внимание ученых. Не будет большим преувеличением сказать, что соединение двух атомов водорода и одного атома кислорода – наиболее тщательно исследованное вещество на планете. И тем не менее специалисты, выбравшие H2O предметом своего интереса, без работы не останутся. Например, они всегда могут заняться изучением того, как же, собственно, жидкая вода превращается в твердый лед.
Процесс кристаллизации, приводящий к столь драматическим изменениям всех свойств, происходит очень быстро, и многие его детали до сих пор остаются неизвестными.
После выхода последнего номера журнала Science одной загадкой стало меньше: теперь ученые точно знают, сколько молекул воды нужно положить в стакан, чтобы на холоде его содержимое превратилось в привычный лед.
Разный лед
Слово «привычный» в предыдущем предложении употреблено не из стилистических соображений. Оно подчеркивает, что речь идет о кристаллическом льде – том самом, с похожей на соты гексагональной решеткой. Хотя привычным такой лед является разве что на Земле – в бесконечном межзвездном пространстве преобладает совсем другая форма льда, которую на третьей планете от Солнца получают в основном в лабораториях. Этот лед называется аморфным, и никакой регулярной структуры у него нет.
Аморфный лед можно получить, если очень быстро (в течение миллисекунд или даже быстрее) и очень сильно (ниже 120 кельвинов – минус 153,15 градуса Цельсия) охладить жидкую воду. В таких экстремальных условиях молекулы H2O не успевают сорганизоваться в упорядоченную структуру, и вода превращается в вязкую жидкость, плотность которой чуть больше плотности льда. Если температура остается низкой, то вода может пребывать в форме аморфного льда очень долго, но при потеплении она переходит в более привычное состояние кристаллического льда.
Аморфным и гексагональным кристаллическим льдом разновидности твердой формы воды не ограничиваются – всего на сегодня ученым известно более 15 ее видов. Самый распространенный на Земле лед носит название лед I h, но в верхних слоях атмосферы можно отыскать и лед I с, кристаллическая решетка которого напоминает решетку алмаза. Другие модификации льда могут быть тригональными, моноклинными, кубическими, ромбическими и псевдоромбическими.
Но в некоторых случаях фазового перехода между этими двумя состояниями не произойдет: если молекул воды будет слишком мало, то вместо того, чтобы формировать строго организованную решетку, они «предпочтут» остаться в менее упорядоченном виде.
«В любом молекулярном кластере взаимодействия на поверхности конкурируют со взаимодействиями внутри кластера, – объяснил "Ленте.ру» один из авторов новой работы, сотрудник института физической химии при Гёттингском университете Томас Цойх (Thomas Zeuch). – Для кластеров меньшего размера энергетически более выгодным оказывается максимально оптимизировать структуру поверхности кластера, нежели формировать кристаллическую «сердцевину». Поэтому такие кластеры остаются аморфными".
Законы геометрии диктуют: по мере роста размеров кластера доля молекул, оказывающихся на поверхности, уменьшается. В какой-то момент энергетическая выгода от формирования кристаллической решетки перевешивает достоинства оптимального расположения молекул на поверхности кластера, и происходит фазовый переход. Но когда именно наступает этот самый момент, ученые не знали.
Группе исследователей, работавших под руководством профессора Удо Бака (Udo Buck) из института динамики и самоорганизации в Гёттингене, удалось дать ответ.
Специалисты показали, что минимальное число молекул, которые могут образовать кристаллик льда, составляет 275 плюс-минус 25 штук.
В своем исследовании ученые использовали метод инфракрасной спектроскопии, модернизированный так, чтобы на выходе можно было отличать спектры, которые дают водяные кластеры, различающиеся по размеру всего на несколько молекул. Созданная авторами методика дает максимальное разрешение для кластеров, включающих от 100 до 1000 молекул – а именно в этом интервале, как считалось, и лежит «пороговое» число, после которого начинается кристаллизация.
Ученые получали аморфный лед, пропуская водяной пар, смешанный с гелием, сквозь очень тоненькое отверстие в вакуумную камеру. Пытаясь протиснуться в крошечную дырочку, молекулы воды и гелия непрерывно сталкивались друг с другом и в этой давке теряли значительную часть своей кинетической энергии. В итоге в вакуумную камеру попадали уже «успокоившиеся» молекулы, легко формирующие кластеры.
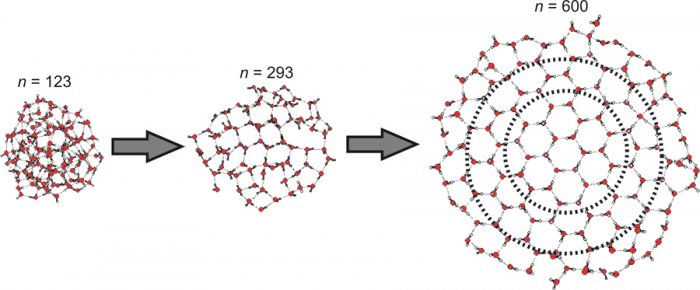 Рис. 3. Возникновение кристаллической решетки при увеличеннии числа молекул воды в кластерах. Изображение Victoria Buch, Cristoph Pradzynski and Udo Buck.
Рис. 3. Возникновение кристаллической решетки при увеличеннии числа молекул воды в кластерах. Изображение Victoria Buch, Cristoph Pradzynski and Udo Buck.
Изменяя количество молекул воды и сравнивая итоговые спектры, исследователи смогли засечь момент перехода от аморфной к кристаллической форме льда (спектры этих двух форм имеют очень характерные отличия). Полученная учеными динамика хорошо согласовывалась с теоретическими моделями, которые предсказывают, что после прохождения «точки Х» формирование кристаллической решетки начинается в середине кластера и распространяется к его краям. Признаком того, что кристаллизация неизбежна (опять же, согласно теоретическим изысканиям), является формирование кольца из шести соединенных водородными связями молекул – именно это и происходит, когда общее число молекул в кластере становится равным 275-ти.
Дальнейшее увеличение числа молекул ведет к постепенному разрастанию решетки, и на стадии 475 штук спектр ледяного кластера уже полностью неотличим от спектра, который дает обычный кристаллический лед.
«Механизм фазового перехода из аморфного состояния в кристаллическое на микроуровне в деталях до сих пор не изучен, – поясняет Цойх. – Мы можем сравнивать наши экспериментальные данные только с теоретическими предсказаниями – и в данном случае согласование оказалось замечательно хорошим. Теперь, отталкиваясь от нынешних результатов, мы вместе с химиками-теоретиками сможем продолжить изучение фазового перехода и, в частности, попытаемся выяснить, насколько быстро он происходит».
Работа Бака и коллег попадает в категорию «чисто фундаментальных», хотя кое-какие практические перспективы у нее тоже есть. Авторы не исключают, что в будущем созданная ими технология изучения водяных кластеров, позволяющая видеть различия при добавлении нескольких молекул, может оказаться востребованной и в прикладных областях.
«В своей статье мы описали все ключевые компоненты технологии, так что в принципе ее вполне можно приспособить для изучения кластеров из других нейтральных молекул. Впрочем, основные принципы устройства лазера были понятны еще в 1917 году, а первый лазер был создан только в 1960-е», – предостерегает от излишнего оптимизма Цойх.
Автор: Ирина Якутенко
- Источник(и):
-
1. lenta.ru
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России