Геномное редактирование превратило лимфоциты в противораковых «универсальных солдат»
Американские ученые повысили эффективность терапии рака Т-лимфоцитами с химерными антигенными рецепторами (CAR-T), использовав для их получения систему CRISPR/Cas9. Результаты работы опубликованы в журнале Nature, им также посвящен сопутствующий редакционный материал.
Технология CAR-T — наиболее перспективный на сегодняшний день экспериментальный метод лечения рака. Он состоит в том, что лимфоциты пациента или донора генетически модифицируют так, чтобы они синтезировали искусственный рецептор, который состоит из фрагмента антитела, распознающего опухолевые клетки, и внутриклеточной части, активирующей лимфоцит. В ходе экспериментов CAR-T успешно излечивали некоторые формы рака, в первую очередь гематологические: наиболее действенными оказались клетки, распознающие антиген В-лимфоцитов CD19. Однако в терапии большинства плотных опухолей их эффективность оказалась недостаточной.
Большинство современных методик производства CAR-T не затрагивают основной рецептор Т-лимфоцитов (TCR). Таким образом, модифицированные клетки экспрессируют иискусственный, и «родной» рецепторы. При этом лимфоциты с TCR, которые специфичны в отношении собственных антигенов организма, относительно быстро уничтожаются естественным путем, чтобы не допустить развития аутоиммунных заболеваний. Это же ослабляет их атаку на опухоли, поскольку часть антигенов раковых клеток совпадают с антигенами здоровых клеток, и приводит к недостаточной эффективности CAR-T. Эксперименты показали, что «выключение» последовательности ДНК, кодирующей постоянный участок альфа-цепи TCR (TRAC), не только повышает эффективность CAR-T, но и позволяет использовать для лечения заранее приготовленные донорские лимфоциты без риска реакции отторжения.
 Т-лимфоцит. Wikimedia Commons
Т-лимфоцит. Wikimedia Commons
Учитывая эти данные, сотрудники Института Слоуна-Кеттеринга усовершенствовали метод получения CAR-T, распознающих CD19. Воспользовавшись системой редактирования генома CRISPR/Cas9, они встроили ген химерного антигенного рецептора непосредственно в последовательность, кодирующую TRAC, тем самым прервав ее и прекратив экспрессию TCR. То есть одним точечным воздействием они решили сразу две задачи: и обеспечили синтез CAR, и лишили лимфоциты «родных» рецепторов.
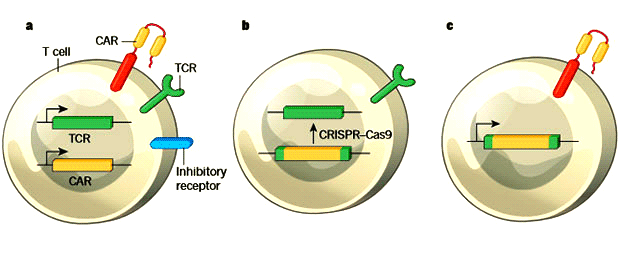 Схема получения CAR-T с помощью CRISPR/Cas9. Marcela V. Maus, Nature, 2017
Схема получения CAR-T с помощью CRISPR/Cas9. Marcela V. Maus, Nature, 2017
В поиске промоторов (участков генов, запускающих их экспрессию), которые обеспечивают равномерный и длительный синтез CAR, ученые испытали на мышах с моделью лейкоза четыре разных промоторных последовательности, а также лишенные промоторов гены CAR, встроенные в два разных участка генома.
Выяснилось, что встраивание гена CAR в последовательность TRAC позволяетему использовать естественный промотор рецепторов Т-клеток, что обеспечивает наиболее стабильную экспрессию CAR и максимальную противоопухолевую эффективность.
Таким образом, разработанная методика позволяет повысить эффективность CAR-T терапии, использовать донорские клетки, что делает технологию более универсальной и снижает ее стоимость. Кроме того, прицельное встраивание гена CAR системой CRISPR/Cas9 связано сменьшим риском побочных эффектов по сравнению со встраиванием в случайный участок генома, которое происходит при использовании вирусного вектора.
Ранее Федеральная комиссия по биологической безопасности и этике США одобрила проведение первого эксперимента по редактированию генома человека с помощью системы CRISPR/Cas9. В ходе испытаний на базе трех клинических центров планируется использовать эту технологию для удаления двух генов CAR-Т-лимфоцитов. Один из них кодирует TCR, а другой — белок PD-1, инактивирующий Т-клетки. Если проведение испытаний одобрят Управление по продуктам и лекарствам США (FDA) и клиники, экспериментальную терапию получат 15 пациентов с множественной миеломой, меланомой и саркомой.
Автор: Олег Лищук
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России