Стволовые клетки обеспечивают клетки-мишени «мини-аптечками»
Согласно исследованию, опубликованному в журнале Molecular Cell, нейральные стволовые клетки – клетки, способные развиться в любой тип нервных клеток, – создают «мини-аптечки» и передают их клеткам-мишеням.
Стволовые клетки открывают широкие возможности в восстановлении пораженных клеток при таких заболеваниях, как рассеянный склероз, инсульт или травмы спинного мозга, так как обладают способностью развиться практически в любой тип клеток. Новое исследование показывает, что помимо замены пораженных клеток здоровыми стволовые клетки оказывают терапевтический эффект посредством совершенно другого механизма.
Группа исследователей во главе с учеными Кембриджского университета (University of Cambridge) показала, что стволовые клетки «общаются» с клетками путем передачи молекул, используя для этого наполненные жидкостью пузырьки, называемые великулами. Цель этого взаимодействия – помочь другим клеткам изменить повреждающую их иммунную реакцию.
Хотя ученые давно полагают, что, зондируя сигналы, мигрируя к определенным областям тела и осуществляя сложные реакции, стволовые клетки могут действовать, как лекарства, молекулярный механизм этого процесса продемонстрирован впервые. Его более глубокое понимание поможет найти пути максимального повышения эффективности терапии на основе стволовых клеток.
«Эти крошечные пузырьки в стволовых клетках содержат молекулы, такие как белки и нуклеиновые кислоты, которые стимулируют клетки-мишени и помогают им выжить. Они действуют как «мини-аптечки», – объясняет руководитель исследования доктор Стефано Плучино (Stefano Pluchino) из Института стволовых клеток Кембриджского университета (Wellcome Trust-Medical Research Council Cambridge Stem Cell Institute). «По сути, они отражают, как стволовые клетки реагируют на воспаленную среду, как та, что наблюдается при сложных нейральных травмах и заболеваниях, и передают эту способность клеткам-мишеням. Мы считаем, что это помогает самовосстановлению поврежденных клеток мозга».
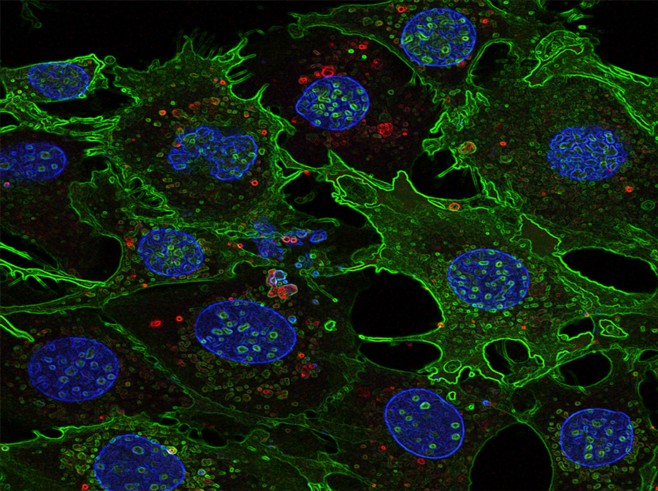 Быстрое (2 часа) in vitro поглощение экстрацеллюлярных везикул клетками-мишенями через плазматическую мембрану.
Быстрое (2 часа) in vitro поглощение экстрацеллюлярных везикул клетками-мишенями через плазматическую мембрану.
(Фото: CongJian Zhao)
При введении в кровь нейральных стволовых клеток (или нейральных клеток-предшественников, НКП) у мышей с повреждением клеток головного мозга – таким, как при рассеянном склерозе, – наблюдается высочайший уровень восстановления. Ученые высказали предположение, что это происходит потому, что НКП секретируют молекулы, управляющие иммунной системой и, в конечном счете, подавляющие повреждение тканей или усиливающие их восстановление.
Доктор Плучино и его коллеги из нескольких стран мира показали, что НКП образуют везикулы, находясь в непосредственной близости от зоны иммунного ответа и особенно в ответ на небольшой белок цитокин интерферон-γ, секретируемый иммунными клетками. Этот белок обладает способностью управлять как иммунными реакциями, так и внутренними программами восстановления мозга и может изменять функцию клеток, регулируя активность десятков генов.
Полученные исследователями данные показывают, что триггером «включения» высоко специфического пути активации генов в НКП является интерферон-γ и что этот белок связывается с рецептором на поверхности везикул. Высвобожденные НКП везикулы поглощаются клетками-мишенями. Помимо того что клетки-мишени получают белки и нуклеиновые кислоты, помогающие им в самовосстановлении, они получает и находящийся на поверхности везикул интерферон-γ, активирующий гены.
«Наша работа освещает удивительную новую роль секретируемых стволовыми клетками везикул в распространении ответа на окружающую микросреду», – добавляет доктор Плучино. «Это значительный шаг вперед в понимании многих уровней взаимодействия между стволовыми клетками и иммунной системой, а также новый молекулярный механизм, объясняющий, как работает основанная на стволовых клетках терапия».
Оригинальная статья:
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России