«Направленная эволюция» в борьбе с болезнями глаз
Новый экспериментальный вирусный вектор переносит терапевтические гены в сетчатку глаза и восстанавливает поврежденные светочувствительные клетки, не требуя введения в эту тонкую и чувствительную ткань хирургической иглы. Такой подход может значительно облегчить лечение наследственных форм глазных заболеваний.
 Через восемь недель после введения
Через восемь недель после введения
экспериментального штамма вируса
в глаз обезьяны активность доставленного им гена
флуоресцентного белка наблюдается по всей сетчатке.
(Фото: technologyreview.com)
Оставаясь в значительной степени экспериментальной, генная терапия постепенно все более приближается к широкому применению в больницах и клиниках. Эта технология тестируется в 2000 завершенных и текущих клинических испытаниях, и в декабре прошлого года Европейский союз одобрил использование генной терапии для лечения одной из форм нарушения обмена веществ. Но до недавнего времени доставка в клетки полезного генетического груза осуществлялась с помощью природных вирусов.
«Эти вирусы «эволюционировали, чтобы добиться успеха в естественных условиях, а мы используем их, чтобы сделать что-то совершенно другое», – говорит руководитель исследования профессор химической и биомолекулярной инженерии Калифорнийского университета в Беркли (University of California, Berkeley) Дэвид Шэффер (David Schaffer), PhD.
Природные вирусы, используемые для доставки генов в глаз, должны вводиться непосредственно в поврежденную сетчатку, что чревато серьезными осложнениями – отделением светочувствительных фоторецепторов от поддерживающего их слоя. Чтобы усовершенствовать этот метод, профессор Шэффер и его коллеги обратились к так называемой «направленной эволюции». Исследователи разработали миллионы случайных вариантов аденоассоциированного вируса – безвредного и часто используемого в качестве средства доставки генов.
Экспериментируя на мышах с двумя различными генетическими формами заболеваний сетчатки, ученые вводили миллионы вирусов в стекловидное тело глаза. Введенные в стекловидное тело природные аденоассоциированные вирусы не могут достичь светочувствительных клеток сетчатки, так как захватываются другими окружающими клетками. Но, тщательно изучив сетчатку грызунов, исследователи нашли штаммы вирусов с мутациями, позволяющими им достичь ткани-мишени. В конечном итоге был идентифицирован самый эффективный штамм, успешно достигающий фоторецепторов сетчатки глаза мыши.
При одном из изученных учеными заболеваний, так называемом Х-хромосомном ретиношизисе, дефектная копия гена, кодирующего клееобразный белок, вызывает расслоение сетчатки, что приводит к потере зрения. Эксперименты показывают, что рабочая версия этого гена, доставляемая новым экспериментальным штаммом вируса, потенциально может обратить это заболевание вспять.
«Вирус разносит ее по всей сетчатке, и так как сетчатка снова «склеивается», ее способность реагировать на свет восстанавливается», – говорит участник исследования нейробиолог Джон Флэннери (John Flannery).
Кроме того, ученые установили, что этот вирусный вектор способен доставить ген и в сетчатку обезьян, хотя в этом случае его эффективность ниже, чем в экспериментах на мышах. В настоящее время идет поиск лучшего штамма для доставки генов в сетчатку приматов.
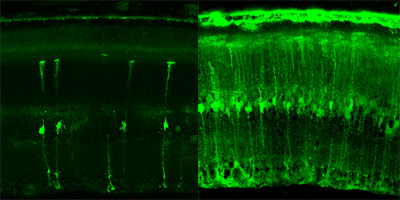 Клетки глаза успешно поглощают вирус, несущий ген зеленого флуоресцентного белка. На снимке хорошо видно, что полученный
Клетки глаза успешно поглощают вирус, несущий ген зеленого флуоресцентного белка. На снимке хорошо видно, что полученный
методом направленной эволюции штамм аденоассоциированного вируса (справа) более эффективен, чем его
предшественник – стандартный вирус. Особенно успешно новый штамм доставляет гены в критически важные фоторецепторы (верхний слой).
(Фото: newscenter.berkeley.edu)
«Направленная эволюция используется целым рядом групп, и, как представляется, является очень надежным способом поиска векторов с новыми свойствами, которые могут быть полезны в генной терапии», – говорит Марк Кей (Mark Kay), MD, PhD, директор программы генной терапия человека Школы медицины Стэнфордского университета (Stanford University School of Medicine). «Этот метод уже был применен при поиске генно-инженерных вирусов, способных более эффективно доставлять терапевтические гены в сердце и другие ткани, и в будущем он, вероятно, будет использоваться еще шире».
По мнению доктора Кея, следующим большим испытанием для метода направленной эволюции будет проверка эффективности доставляющих ДНК вирусов на пациентах. Результаты, полученные на лабораторных животных, не всегда воспроизводятся в организме человека, даже если это близкие биологические виды, поясняет ученый.
Статья In Vivo–Directed Evolution of a New Adeno-Associated Virus for Therapeutic Outer Retinal Gene Delivery from the Vitreous опубликована в журнале Science Translational Medicine.
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России