Транспортировка внутриклеточных белков подчиняется простым правилам
Всему живому на Земле угрожает хаос. В этом смысле клетка подобна лодке, которая в любой момент может утонуть в море хаоса. Чтобы сохранять один и тот же уровень порядка и не утонуть, она должна постоянно получать энергию – образно говоря, накапливающуюся воду хаоса нужно постоянно откачивать.
Ученые из Института молекулярной физиологии Макса Планка (Max Planck Institute of Molecular Physiology) в Дортмунде открыли, как клетки обеспечивают правильное распределение белков в своей внутренней среде. Они обнаружили, что многие из белков, которые должны быть перемещены к клеточной мембране, снабжены своего рода якорем, представляющим собой молекулу жирной кислоты, предназначенным для встраивания белков в клеточные мембраны. Но так как мембрана – это то место, откуда белки получают доступ к клеточным органеллам, через некоторое время якорь из белков удаляется. Таким образом, клетка использует неспецифический подход, чтобы заделать эту брешь, за исключением тех случаев, когда транспортировка идет к мембране.
Таким образом, ученые открыли простой принцип, который клетки используют для регуляции сложной локализации белков и тем самым сохраняют высокий уровень порядка. Более того, эти открытия могут проложить путь к новым методам лечения рака: в дополнительном исследовании, используя новый ингибитор, ученые смогли успешно изменить пространственное распределение ракового белка Ras, тем самым нарушая его трансформационные сигналы.
В клетке присутствует огромное количество веществ, которые нужно транспортировать. Органелла, известная как аппарат Гольджи, служит «сортировочной станцией» для этого процесса. Белки и другие вещества подготавливаются к выполнению присущих им функций и транспортировке внутри аппарата Гольджи, окруженного своей собственной мембраной. Маленькие везикулы отделяются от этой мембраны и направляются к месту их конечного назначения. Многие белки, которые должны быть перенесены к клеточной мембране, сначала снабжаются молекулой жирной кислоты, или липида. Этот процесс, известный как пальмитация, обеспечивает мембранные белки своего рода адресным ярлычком и переносит их к клеточной мембране. Клетка использует эту направленную транспортировку от аппарата Гольджи к клеточной мембране как средство борьбы с постоянно существующей «утечкой» в другие мембраны. Это важно, так как помимо клеточной мембраны клетка наполнена мембранами органелл, связанных друг с другом посредством везикул. Следовательно, пальмитированные мембранные белки, изначально предназначенные только для клеточной мембраны, попадают и в другие места. Со временем такие белки будут случайным образом распределены по всей клетке.
Ученые использовали самые передовые методы микроскопии для наблюдения за специальными молекулярными датчиками в живых клетках и проанализировали локализацию и транспортировку пальмитированных белков в реальном времени. Они обнаружили, что пальмитирование преимущественно происходит в аппарате Гольджи. Пальмитированные белки достигают клеточной мембраны, находясь на поверхности отделившихся от аппарата Гольджи везикул. Чтобы предотвратить встраивание белков в другие мембраны, специальные ферменты удаляют липидные якоря из всех пальмитированных белков без разбора. Затем белки свободно плавают в клетке до тех пор, пока не оказываются заброшенными обратно в транспортную сеть аппарата Гольджи. Таким образом, клетка гарантирует, что дезориентированные белки быстро и постоянно снабжают транспортную сеть и переправляются к правильному месту назначению.
«Это неравновесное состояние, которое может поддерживаться только постоянным потреблением энергии, и именно оно характеризует понятие жизнь – в отличие от сложных неживых систем, таких как кристаллы, которые приходят в состояние равновесия с минимальными затратами энергии», – объясняет Филипп Бастиенс (Philippe Bastiaens), заведующий кафедрой системной биологии клетки Института молекулярной физиологии Макса Планка.
Таким образом, ученые открыли основополагающий принцип жизни.
Сложная задача – простое решение
Но откуда клетка знает, какие белки нужно отправить в клеточную мембрану, пока они находятся в аппарате Гольджи? Ученые считают, что любой белок может получить липидный якорь, если он имеет на поверхности аминокислоту цистеин, к которой есть удобный доступ. Такой белок будет доставлен к клеточной мембране автоматически. Поэтому такая транспортировка не требует рецепторов, которые бы специфически связывались с белком в том месте клетки, куда он должен попасть.
Это великолепный пример того, как сложный процесс может контролироваться простыми физическими или химическими правилами. На первый взгляд может показаться, что определить белки, которые должны быть перенесены в определенное место, отличить те, которые были перенесены в ненадлежащее место, и предотвратить их отклонение от конечного пункта назначения – чрезвычайно сложная задача. Но клетка справляется с этим очень простым способом, без каких-либо дополнительных рецепторов или механизмов регуляции. Другие самоорганизующиеся системы – такие как колонии насекомых – также часто работают на относительно простых принципах. Иначе они не смогут выполнять то множество задач, с которыми должны справляться.
«Наши открытия – это веха. Они изменят принцип исследований, применяемый в клеточной биологии. Только когда мы как ученые понимаем принципы устройства жизни, мы действительно способны понять, что такое жизнь. Сосредоточение на множестве различных клеточных сигнальных путей на самом деле сильно помочь нам в этот не может», – говорит Бастиенс.
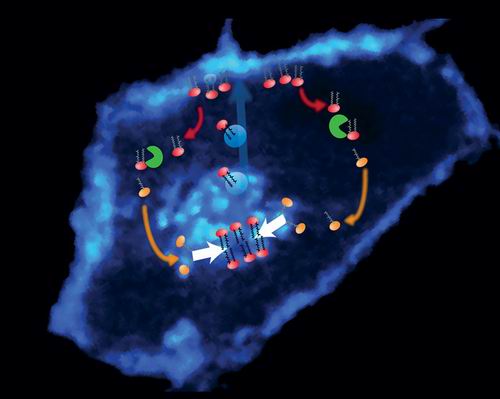 Изображение пространственного распределения белка Ras (флуоресцентный синий), встроенного в клеточную мембрану (по краям) и аппарат Гольджи (в центре). Фотомонтах показывает, как поддерживается баланс распределения белка Ras: белок с липидным якорем (красный) переносится мембранными пузырьками (голубые кружки) из аппарата Гольджи к клеточной мембране. Фермент APT1 (зеленый) удаляет якорь, полученный в процессе пальмитации, из тех молекул Ras, которые встроены в другие мембраны. Депальмитированный Ras (оранжевый) свободно плавает по клетке, а затем поглощается аппаратом Гольджи, после чего весь цикл повторяется. Таким образом, клетки используют простой принцип транспортировки Ras и других пальмитированных белков к месту их назначения: локализованный центр распределения (Гольджи), направленный транспорт к месту назначения, а также удаление целевых мишеней (депальмитация) и последующее возвращение в транспортный цикл. (Фото Филиппа Бастиенса)
Изображение пространственного распределения белка Ras (флуоресцентный синий), встроенного в клеточную мембрану (по краям) и аппарат Гольджи (в центре). Фотомонтах показывает, как поддерживается баланс распределения белка Ras: белок с липидным якорем (красный) переносится мембранными пузырьками (голубые кружки) из аппарата Гольджи к клеточной мембране. Фермент APT1 (зеленый) удаляет якорь, полученный в процессе пальмитации, из тех молекул Ras, которые встроены в другие мембраны. Депальмитированный Ras (оранжевый) свободно плавает по клетке, а затем поглощается аппаратом Гольджи, после чего весь цикл повторяется. Таким образом, клетки используют простой принцип транспортировки Ras и других пальмитированных белков к месту их назначения: локализованный центр распределения (Гольджи), направленный транспорт к месту назначения, а также удаление целевых мишеней (депальмитация) и последующее возвращение в транспортный цикл. (Фото Филиппа Бастиенса)
Новое вещество подавляет раковый белок
Ученые пошли на шаг дальше, заложив основы для потенциального использования своих открытий в терапии рака. Белок Ras – яркий представитель пальмитированных белков. Мутации и гене ras обнаруживаются в клетках многих форм рака. Однако Ras способен полноценно функционировать, только когда он встроен в клеточную мембрану и не попадает в другие мембраны. Поэтому ученые разработали ингибитор, который назвали пальмостатином B, для противодействия ферменту, ответственному за отделение липидного якоря. Если такой фермент «выключен», пальмитированный Ras остается встроенным в клеточную мембрану, откуда он попадает в мембраны других органелл.
«Это совершенно новый подход – фактически он противоречит здравому смыслу. Поэтому он никогда не разрабатывался в фармацевтических исследованиях. Мы же сделали следующее: вместо подавления направленной транспортировки из аппарата Гольджи способствовали его случайному распределению в клетке», – объясняет Герберт Вальдманн (Herbert Waldmann), заведующий кафедрой химической биологии в Институте Макса Планка.
Использовав пальмостатин В, ученые впервые смогли подавить белок Ras без полного его отключения. Если Ras полностью инактивирован, умирает даже здоровая клетка. В противоположность этому случайное его распределение в клетке подавляет только вредное влияние мутировавшего варианта белка. Раковые клетки снова становятся здоровыми. Благодаря этому открытию Ras-зависимые опухоли когда-нибудь будут лечить методами, не приносящими вреда здоровым клеткам.
Аннотации к статьям
Oliver Rocks, Marc Gerauer, Nachiket Vartak, Sebastian Koch, Zhi-Ping Huang, Markos Pechlivanis, Jürgen Kuhlmann, Lucas Brunsveld, Anchal Chandra, Bernhard Ellinger. The Palmitoylation Machinery Is a Spatially Organizing System for Peripheral Membrane Proteins
Frank J. Dekker, Oliver Rocks, Nachiket Vartak, Sascha Menninger, Christian Hedberg, Rengarajan Balamurugan, Stefan Wetzel, Steffen Renner, Marc Gerauer, Beate Schölermann, Marion Rusch, John W. Kramer, Daniel Rauh, Geoffrey J. Coates, Luc Brunsveld, Philippe Bastiaens, Herbert Waldmann. Small-molecule inhibition of APT1 affects Ras localization and signaling
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России