Новый метод флуоресцентной маркировки белков
Химики из Массачусетского технологического института (Massachusetts Institute of Technology – MIT) разработали новый метод флуоресцентной маркировки белков, способный пролить свет на ранее неизвестные их функции.
В 90-х годах прошлого века зеленый флуоресцентный белок, известный как GFP, революционизировал клеточную биологию. Впервые обнаруженный и выделенный из тихоокеанской медузы Aequorea victoria в 1962 году белок GFP позволяет ученым визуализировать внутриклеточные белки и отслеживать выполнение ими своих функций. Два года назад биологам, открывших этот белок и разработавшим метод его применения как инструмента для лабораторных исследований, была присуждена Нобелевская премия.
Однако использование GFP как флуоресцентного датчика имеет один большой недостаток – белок такой громоздкий, что вмешивается в функционирование помеченных им белков, не позволяя им выполнять их обычные функции или достигать пункта назначения в процессе внутриклеточной транспортировки.
«Ученые давно пытаются найти лучшие способы маркировки белков», – говорит Кэтрин Вайт (Katharine White), аспирант лаборатории Элис Тинг (Alice Ting), доцента химии в MIT.
Тинг, Вайт и их коллеги придумали новый способ преодоления присущих GFP недостатков, пометив белки маркером гораздо меньшего размера. Их маркеры позволяют белкам нормально выполнять их обычные функции, предоставляя ученым возможность наблюдать за деятельностью молекул, которую еще никто и никогда не видел.
Свой метод, названный ПРАЙМ (PRIME – PRobe Incorporation Mediated by Enzymes – инкорпорация маркера посредством ферментов), ученые описали в Proceedings of the National Academy of Sciences.
Флуоресцентный белок GFP позволяет ученым отследить белки, которые невозможно увидеть никаким другим способом, и понять, как они перемещаются в клетке, руководя процессом ее деления и метаболизмом. Чтобы добиться такой возможности, исследователи добавляют кодирующий GFP ген к гену белка, который собираются изучать. После введения такого инженерного гена в клетки, он начинает производить белки, светящиеся зеленым флуоресцирующим светом.
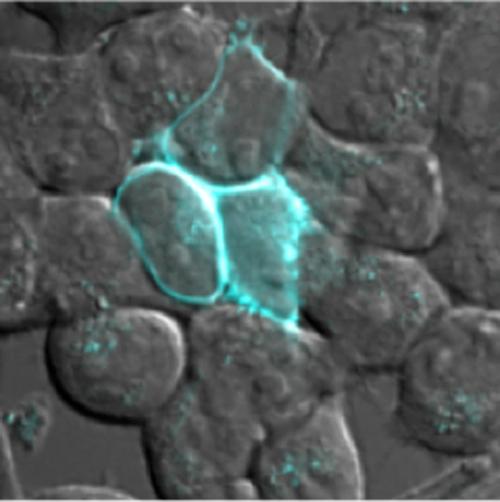 Ученые из Массачусетского технологического института разработали флуоресцентный маркер, который может быть ориентирован на разные части клетки. На снимке датчик маркирует белки, находящиеся только в клеточной мембране. (Credit: Katharine White and Tao Uttamapinant)
Ученые из Массачусетского технологического института разработали флуоресцентный маркер, который может быть ориентирован на разные части клетки. На снимке датчик маркирует белки, находящиеся только в клеточной мембране. (Credit: Katharine White and Tao Uttamapinant)
Однако белок такого большого размера, как GFP (238 аминокислот), может вступать в конфликт с другими белками, такими как актин – молекула, определяющая структуру клеток, обеспечивающая их подвижность и способность к коммуникации с другими клетками и принимающая участие в клеточном делении.
«Флуоресцентные белки используются для изучения актина уже давно, но слияние с ними оказывает негативное влияние на функции и перемещение самого актина», – объясняет Тао Уттамапинант (Tao Uttamapinant), один из первых авторов статьи в PNAS.
Чтобы преодолеть недостатки GFP, Тинг и ее ученики использовали голубой флуоресцентный маркер значительно меньшего размера, чем GFP. В противоположность GFP новый маркер не связан с белком-мишенью в процессе его производства внутри клетки. С помощью нового фермента, специально разработанного исследователями, маркер прикрепляется к своей мишени позднее.
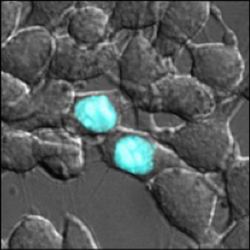 Маркер помечает белки в ядре клетки.
Маркер помечает белки в ядре клетки.
Фото: Katharine White and Tao Uttamapinant
Чтобы все это работало, ученые должны добавить ген нового фермента, известного как флуорофор-лигаза (fluorophore ligase), в каждую клетку одновременно с добавлением гена интересующего их белка. Параллельно с этим к белку-мишени прикрепляется короткая метка (13 аминокислот), позволяющая ферменту узнавать нужный белок. Когда в клетку добавляется голубой флуоресцентный маркер (7-гидроксикумарин – 7-hydroxycoumarin), фермент присоединяет его к короткой метке белка-мишени.
При использовании этого метода такие белки как актин могут свободно перемещаться по всей клетке и проникать в ее ядро, даже если они помечены флуоресцентным датчиком.
Исследователи также продемонстрировали, что можно пометить белки только в определенных частях клетки, например, в ядре, клеточной мембране или цитозоле, добавив к ферменту специфические генетические последовательности. В таком случае фермент будет прикреплять флуоресцентную метку только к белкам с определенной локализацией.
«Способность связываться с белками в определенной части клетки является самой впечатляющей особенностью нового метода», – комментирует разработку Джун Инь (Jun Yin), доцент химии из Университета Иллинойса (University of Illinois), Чикаго, не принимавший участия в этом исследовании. «Если вы изучаете белок, то первое, что вы хотите узнать, – это где он локализуется и каков маршрут его движения».
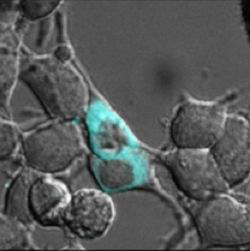 Маркер помечает белки в цитозоле.
Маркер помечает белки в цитозоле.
Фото: Katharine White and Tao Uttamapinant
Инь, также занимающийся проблемой маркировки белков, считает, что разработанный в MIT новый метод достаточно универсален и может быть успешно модифицирован для обнаружения и других изменений в клетке. «Его можно использовать не только с флуорофорами, но и с другими датчиками, реагирующими на внутриклеточное микроокружение, например, на изменение кислотности или концентрации ионов», что прольет дополнительный свет на клеточные функции, считает ученый.
В настоящее время ученые из MIT занимаются разработкой ферментов, способных работать с другими типами флуоресцентных маркеров. Тинг также подала заявку на патент и собирается коммерциализировать свою технологию, чтобы ее могли использовать другие лаборатории.
Статья в Proceedings of the National Academy of Sciences: Chayasith Uttamapinant, Katharine A. White, Hemanta Baruah, Samuel Thompson, Marta Fernádez-Suárez, Sujiet Puthenveetil, and Alice Y. Tin. A fluorophore ligase for site-specific protein labeling inside living cells.
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России