Биоинформатика определяет структуру мембранных белков: прогнозирование и эксперимент идут рука об руку
Мембранные белки имеют огромное биологическое и фармакологическое значение. Насчитывается всего несколько случаев успешного определения их точной структуры. Ученым из Колумбийского университета (Columbia University), Нью-Йорк, и Технического университета Мюнхена (Technische Universitaet Muenchen – TUM) удалось определить структуру важного ионного канала путем анализа родственных ему белков. Доклад об их открытии опубликован в журнале Nature.
Белки – это молекулярные машины, которые транспортируют различные химические соединения, катализируют химические реакции, являются ионными насосами и определяют сигнальные вещества. Они представляют собой цепочки аминокислот, и для многих их них специфические аминокислотные последовательности уже известны. Однако те функции, которые белок может выполнять внутри клетки, определяются его трехмерной пространственной структурой. Определение этой так называемой третичной структуры белка представляет собой большую сложность для ученых. С целью достичь значительного прогресса в медицинских и биологических исследованиях Национальный институт общих медицинских наук (National Institute of General Medical Sciences – NIGMS) Национального института здравоохранения (National Institutes of Health – NIH) США за последние десять лет в рамках проекта Protein Structure Initiative инвестировал в эту область свыше 500 миллионов долларов.
В этом крупномасштабном проекте принимали участие профессор информатики Буркхард Рост (Burkhard Rost) и Марко Пунта (Marco Punta) из Института перспективных исследований (Institute for Advanced Study- IAS) TUM. Институт связан с Нью-Йоркским консорциумом структуры мембранного белка (New York Consortium on Membrane Protein Structure – NYCOMPS), где особое внимание уделяется белкам мембран, так как они имеют огромное значение для фармакологических исследований. До того как лекарственное вещество попадает в клетку, оно обычно взаимодействует с мембранными белками. Знание структуры белка важно для понимания такого взаимодействия на молекулярном уровне.
Однако расшифровка третичной структуры этих очень важных белков экспериментальными способами особенно сложна. Например, серьезной проблемой является рекомбинантный синтез многих мембранных белков, так же как и их очистка и кристаллизация. В результате, несмотря на то, что 25 процентов всех белков – это мембранные белки, они составляют менее одного процента от общего количества белков, структура которых известна. Учитывая их медицинскую значимость, они должны быть изучены гораздо лучше.
Поскольку проведение экспериментального анализа мембранных белков может занять несколько лет, ученые NYCOMPS использовали биоинформационную стратегию, так называемое гомологическое моделирование, или моделирование по гомологии. Основным положением этой стратегии является то, что белки с общими эволюционными предшественниками похожи друг на друга как по аминокислотным последовательностям, так и по трехмерной структуре. Если структуру одного из родственных белков можно определить экспериментально, структура остальных может быть спрогнозирована.
Ученым удалось полностью решить эту сложную головоломку в случае бактериального мембранного белка TehA.
«В процессе скрининга мы искали родственные TehA мембранные белки, сравнивая десятки тысяч аминокислотных последовательностей. Используя многоступенчатый отбор, мы выбрали 43 белка из 38 различных организмов», – говорит специалист в области вычислительной биологии Марко Пунта.
Ученым Колумбийского университета удалось экспериментально определить третичную структуру мембранного белка TehA бактерии Haemophilus influenzae, используя рентгеновскую кристаллографию. С разрешением 0.12 нанометров (1.2 ангстрем), эта структура является одной из лучших когда-либо полученных кристаллических структур мембранных белков. Более того, эксперимент преподнес сюрприз: мембранный протеин TehA имеет совершенно не известный до сих пор фолдинг.
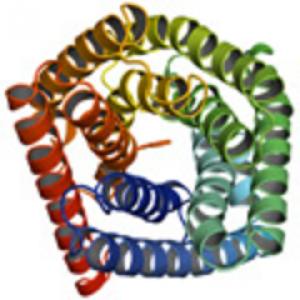 Вид канала мембранного белка SLAC1 растительных клеток.
Вид канала мембранного белка SLAC1 растительных клеток.
(Credit: Image courtesy of Technische Universitaet Muenchen)
Получив информацию о семействе белков TehA, ученые Колумбийского университета смогли спрогнозировать структуры отдельных белков. В частности, они смоделировали структуру мембранного белка растений SLAC1. Сравнив ее со структурой TehA, полученной экспериментальным путем, они смогли создать структурную модель SLAC1 – совсем без экспериментов, используя только методы биоинформатики.
«Используя такие методы, мы стремимся повысить скорость определения структуры. Определение большего количества белковых структур в более короткие сроки – вот что было нашей целью, в частности, для мембранных белков. Полученные результаты показали, что такая стратегия может работать на мембранных белках», – говорит Буркхард Рост.
В конечном итоге трехмерные структуры используются для определения функции белков в тестах с использованием мутагенеза. Хотя мембранные белки TehA and SLAC1 состоят только в отдаленном родстве – общими для них являются всего 19 процентов аминокислотных последовательностей – предсказанная третичная структура SLAC1 оказалась настолько точна, что была предложена новая гипотеза о функции этого белка.
Белок SLAC1 находится в устьицах растения Арабидопсис (Arabidopsis thaliana). Устьица регулируют обмен водяного пара и диоксида углерода между растением и окружающей его средой. Это очень важно при фотосинтезе. Мембранный белок SLAC1 также играет в этом процессе определенную роль, являясь частью анионного канала: он оказывает влияние на тургор – давление клеточной жидкости на стенку клетки – и, таким образом, на обмен газов растительной клетки как реакцию на факторы окружающей среды, такие как низкая концентрация водяного пара или высокая концентрация диоксида углерода.
Для анионных каналов SLAC1 характерна совершенно новая структура и, очевидно, механизм ионной проводимости. Канал SLAC1 имеет по всей длине относительно одинаковый диаметр, но в его средней части путь преграждает фенилаланиновая группа. Недавно полученные результаты дают основание предположить, что эта аминокислота убирается из канала, когда он активируется связыванием с каким-либо триггерным белком.
Аннотация к статье: Yu-hang Chen, Lei Hu, Marco Punta, Renato Bruni, Brandan Hillerich, Brian Kloss, Burkhard Rost, James Love, Steven A. Siegelbaum, Wayne A. Hendrickson. Homologue structure of the SLAC1 anion channel for closing stomata in leaves
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России