Литий-ионным аккумуляторам исполнилось 25 лет. Почему за четверть века их активные материалы так мало изменились
В этом году исполнилось 25 лет с момента выхода в продажу первых литий-ионных аккумуляторов, которые изготовила корпорация Sony в 1991 году. За четверть века их ёмкость практически удвоилась с 110 Втч/кг до 200 Втч/кг, но, несмотря на такой колоссальный прогресс и на многочисленные исследования электрохимических механизмов, сегодня химические процессы и материалы внутри литий-ионных аккумуляторов практически те же, что и 25 лет назад. В этой статье будет рассказано, как шло становление и развитие данной технологии, а также с какими трудностями сталкиваются сегодня разработчики новых материалов.
1. Развитие технологии: 1980–2000
Ещё в 70х годах учёными было установлено, что существуют материалы под названием халькогениды (например, MoS2), которые способны вступать в обратимую реакцию с ионами лития, встраивая их в свою слоистую кристаллическую структуру. Тут же был предложен первый прототип литий-ионного аккумулятора, состоящий из халькогенидов на катоде и металлического лития на аноде. Теоретически, во время разрядки, ионы лития, «высвобождаемые» анодом, должны встраиваться в слоистую структуру MoS2, а при зарядке оседать обратно на аноде, возвращаясь в исходное состояние.
Но первые попытки создания таких аккумуляторов были неудачны, так как при зарядке ионы лития никак не хотели обратно превращаться в ровную пластину металлического лития, а оседали на аноде как попало, приводя к росту дендритов (цепочек металлического лития), короткому замыканию, и взрыву аккумуляторов. За этим следовал этап детального изучения реакции интеркаляции (встраивания лития в кристаллы с особой структурой), что позволило заменить металлический литий на углерод: сначала на кокс, а потом и на графит, который используется до сих пор и тоже имеет слоистую структуру, способную встраивать ионы лития.
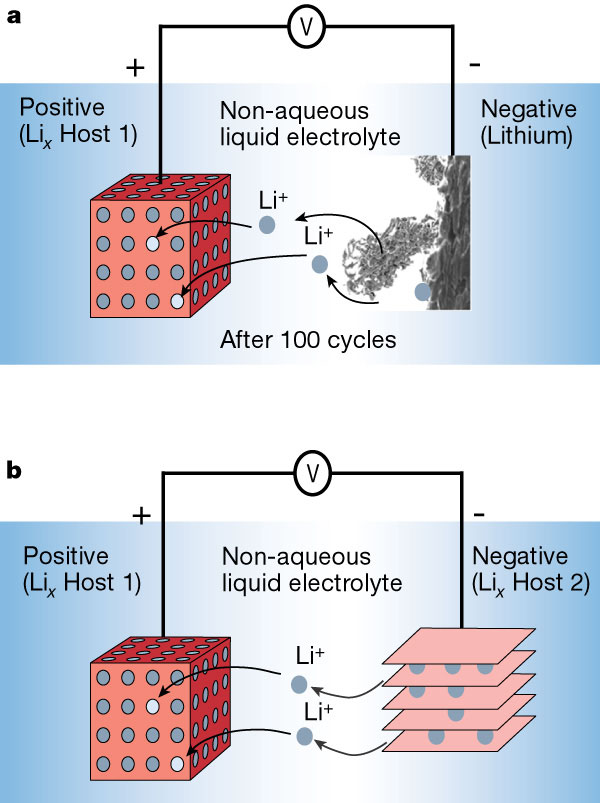 Литий-ионный аккумулятор с анодом из металлического лития (а) и анодом из слоистого материала (b). Источник: nature.com
Литий-ионный аккумулятор с анодом из металлического лития (а) и анодом из слоистого материала (b). Источник: nature.com
Начав использовать углеродные материалы на аноде, учёные поняли, что природа сделала человечеству большой подарок. На графите, при самой первой зарядке, образуется защитный слой из разложившегося электролита, названный SEI (Solid Electrolyte Interface). Точный механизм его формирования и состав еще не до конца изучены, но известно, что без этого уникального пассивирующего слоя электролит продолжал бы разлагаться на аноде, электрод бы разрушался, и аккумулятор приходил бы в негодность. Так появился первый работающий анод на основе углеродных материалов, который был выпущен в продажу в составе литий-ионных аккумуляторов в 90-х годах.
Одновременно с анодом видоизменялся и катод: выяснилось, что слоистой структурой, способной встраивать ионы лития, обладают не только халькогениды, но и некоторые оксиды переходных металлов, например LiMO2 ( M = Ni, Co, Mn), которые не только более стабильны химически, но и позволяют создавать ячейки с более высоким напряжением. И именно LiCoO2 был использован в катоде первого коммерческого прототипа аккумуляторов.
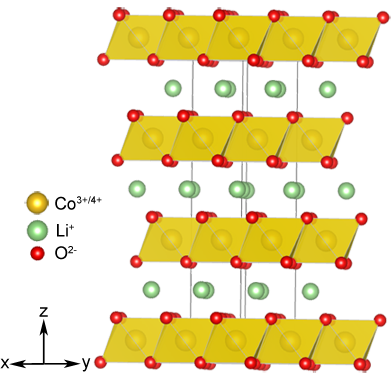 Источник: www.iycr2014.org
Источник: www.iycr2014.org
2. Новые реакции и мода на наноматериалы: 2000–2010
В 2000х в науке начался бум наноматериалов. Естественно, прогресс в нанотехнологиях не обошёл стороной и литий-ионные аккумуляторы. И именно благодаря им учёные сделали совершенно, казалось бы, непригодный для данной технологии материал, LiFePO4, одним из лидеров по использованию в катодах электромобильных аккумуляторов.
А дело всё в том, что обычные, объёмные частицы железофосфата очень плохо проводят ионы, да и электронная проводимость у них очень низкая. Но засчёт наноструктурирования литию не надо продвигаться на большие расстояния чтобы встроиться в нанокристалл, поэтому интеркаляция проходит гораздо быстрее, а покрытие нанокристаллов тонкой углеродной плёнкой улучшает их проводимость. В результате в продажу вышел не только менее опасный материал, который не выделяет кислород при высокой температуре (как оксиды), но и материал имеющий способность работать на более высоких токах. Именно поэтому такой катодный материал предпочитают производители автомобилей, несмотря на чуть меньшую ёмкость чем у LiCoO2.
В то же время учёные искали новые материалы, взаимодействующие с литием. И, как выяснилось, интеркаляция, или встраивание лития в кристалл- не единственный вариант реакции на электродах в литий-ионных аккумуляторах. Так, например, некоторые элементы, а именно Si, Sn, Sb, и т.д., формируют «сплав» с литием, если использовать их в аноде. Ёмкость такого электрода в 10 раз превышает ёмкость графита, но есть одно «но»: такой электрод во время формирования сплава сильно увеличивается в объёме, что приводит к его быстрому растрескиванию и приходу в негодность. И для того, чтобы уменьшить механическое напряжение электрода при таком увеличении объёма, элемент (например, кремний) предлагают использовать в виде наночастиц, заключённых в углеродную матрицу, которая «амортизирует» изменения объёма.
 Источник: chargedevs.com
Источник: chargedevs.com
Но изменения объёма- не единственная проблема материалов, образующих сплавы, и препятствующая их широкому применению. Как было сказано выше, на графите образуется «подарок природы»- SEI. А на материалах, образующих сплав, электролит разлагается непрерывно и повышает сопротивление электрода. Но тем не менее, периодически мы видим в новостях, что в некоторых аккумуляторах используется «кремниевый анод». Да, кремний в нём действительно используется, но в очень маленьких количествах и смешанный с графитом, чтобы «побочные эффекты» не слишком были заметны. Естественно, когда количество кремния в аноде составляет всего несколько процентов, а остальное- графит, значительного увеличения ёмкости не получится.
И если тема анодов, образующих сплавы, сейчас развивается, то некоторые исследования, начатые в прошлом десятилетии, очень быстро заходили в тупик. Это касается, например, так называемых реакций конверсии. В этой реакции некоторые соединения металлов (оксиды, нитриды, сульфиды и т.д.) взаимодействуют с литием, превращаясь в металл, смешанный с соединениями лития:
MaXb ⇒ aM + bLinX
M: металл
X: O, N, C, S…
И, как можно себе представить, с материалом во время такой реакции происходят такие изменения, которые даже кремнию не снились. Например, оксид кобальта превращается в наночастицы металлического кобальта, заключённые в матрицу из оксидов лития:
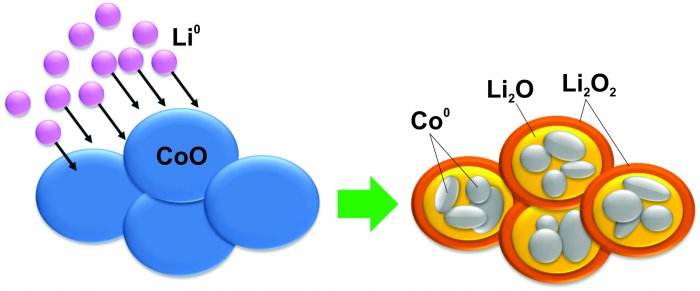 Источник: J. Phys. Chem C 117, 14518 (2013)
Источник: J. Phys. Chem C 117, 14518 (2013)
Естественно, такая реакция плохо обратима, к тому же между зарядкой и разрядкой большая разница напряжений, что делает такие материалы бесполезными в применении.
Интересно заметить, что когда эта реакция была открыта, в научных журналах стали публиковаться сотни статей на эту тему. Но тут хочется процитировать профессора Тараскона из Коллеж де Франс, который сказал, что «реакции конверсии были настоящим полем экспериментов для исследования материалов с наноархитектурой, что давало учёным возможность делать красивые картинки с помощью просвечивающего электронного микроскопа и публиковаться в известных журналах, несмотря на абсолютную практическую бесполезность этих материалов».
В общем, если подвести итог, то, несмотря на то, что в последнее десятилетие были синтезированы сотни новых материалов для электродов, в аккумуляторах до сих под используются практически те же материалы, что и 25 лет назад. Почему же так получилось?
3. Настоящее время: главные трудности в разработке новых аккумуляторов.
Как можно заметить, в вышеописанном экскурсе в историю литий-ионных аккумуляторов ни слова не было сказано об ещё одном, важнейшем элементе: электролите. И на это есть причина: электролит за 25 лет практически не изменился и работающих альтернатив предложено не было. Сегодня, как и в 90-е годы, в виде электролита используются соли лития (в основном LiPF6) в органическом растворе карбонатов (этилен карбонат (EC) + диметил карбонат (DMC)). А ведь именно из-за электролита прогресс в увеличении ёмкости аккумуляторов в последние годы замедлился.
Приведу конкретный пример: на сегодняшний день существуют материалы для электродов, которые могли бы значительно увеличить ёмкости литий-ионных аккумуляторов. К ним относится, например, LiNi0.5Mn1.5О4, который позволил бы сделать аккумулятор с напряжением ячейки в 5 Вольт. Но увы, в таких диапазонах напряжения электролит на основе карбонатов становится нестабильным. Или ещё один пример: как было сказано выше, сегодня, чтобы использовать значительные количества кремния (или других металлов, образующих сплавы с литием) в аноде, надо решить одну из главных проблем: образование пассивирующего слоя (SEI), который бы препятствовал непрерывному разложению электролита и разрушению электрода, а для этого надо разработать принципиально новый состав электролита. Но почему же так сложно найти альтернативу существующему составу, ведь солей лития полно, да и органических растворителей достаточно?!
А трудность заключается в том, что электролит должен одновременно обладать следующими характеристиками:
- Он должен быть химически стабилен во время работы аккумулятора, а точнее, он должен быть стойким по отношению к окисляющему катоду и восстанавливающему аноду. Это значит, что попытки увеличить энергоёмкость аккумулятора, то есть, использование ещё более окисляющих катодов и восстанавливающих анодов, не должны приводить к разложению электролита.
- Электролит также должен обладать хорошей ионной проводимостью и низкой вязкостью для транспортировки ионов лития в широком диапазоне температур. Именно для этого в вязкий этилен карбонат добавляют DMC начиная с 1994 года.
- Соли лития должны хорошо растворяться в органическом растворителе.
- Электролит должен формировать эффективный пассивирующий слой. У этилен карбоната это прекрасно получается, в то время как другие растворители, например пропилен карбонат, который был изначально опробован Sony, разрушает структуру анода, так как встраивается в него параллельно с литием.
Естественно, создать электролит, обладающий сразу всеми данными характеристиками очень сложно, но учёные не теряют надежды. Во-первых, ведутся активные поиски новых растворителей, которые бы работали в более широком диапазоне напряжений, чем карбонаты, что позволило бы использовать новые материалы и увеличить энергоёмкость аккумуляторов. В разработке находятся несколько видов органических растворителей: эстеры, сульфоны, сульфоксиды и т.д. Но увы, увеличивая устойчивость электролитов к окислению, уменьшается их устойчивость к восстановлению, и в результате напряжение ячейки никак не меняется. К тому же, не все растворители формируют на аноде защитный пассивирующий слой. Именно поэтому зачастую в электролит подмешивают специальные добавки, например, винилен карбонат, которые искусственно способствуют формированию этого слоя.
Параллельно с улучшением уже существующих технологий, учёные работают и над принципиально новыми решениями. И решения эти можно свести к попытке избавиться от жидкого растворителя на основе карбонатов. К таким технологиям относятся, к примеру, ионные жидкости. Ионные жидкости-это, по сути, расплавленные соли, у которых очень низкая температура плавления, и некоторые из них даже при комнатной температуре остаются жидкими. А всё из-за того, что у этих солей особенная, стерически затрудненная структура, которая усложнят кристаллизацию.
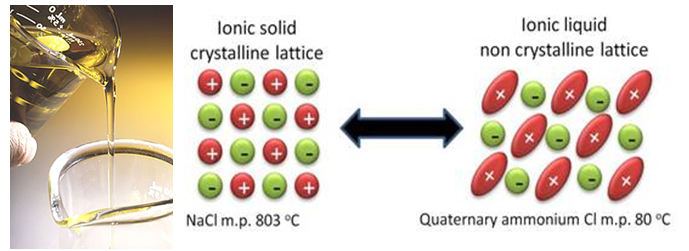 Источник: www.eurare.eu
Источник: www.eurare.eu
Казалось бы, отличная идея- полностью исключить растворитель, который легко воспламеняется и вступает в паразитические реакции с литием. Но на деле, исключение растворителя создаёт на данный момент больше проблем, чем решает. Во-первых, в обычных электролитах часть растворителя «приносит себя в жертву» для построения защитного слоя на поверхности электродов. А компоненты ионных жидкостей с этой задачей пока не справляются (анионы, кстати, тоже могут вступать в паразитические реакции с электродами, как и растворители). Во-вторых, очень сложно подобрать ионную жидкость с правильным анионом, так как они влияют не только на температуру плавления соли, но и на электрохимическую стабильность. И увы, самые стабильные анионы формируют соли, которые плавятся при высоких температурах, и, соответственно, наоборот.
Ещё один способ избавиться от растворителя на основе карбонатов- использование твёрдых полимеров (например, полиэфиров), проводящих литий, которые, во-первых, минимизировали бы риск утечки электролита наружу, а также препятствовали бы росту дендритов при использовании металлического лития на аноде. Но главная сложность, стоящая перед создателями полимерных электролитов- их очень низкая ионная проводимость, так как ионам лития сложно передвигаться в такой вязкой среде. Это, конечно, сильно ограничивает мощность аккумуляторов. А понижения вязкости влечёт за собой прорастание дендритов.
 Источник: www.polito.it
Источник: www.polito.it
Также исследователи изучают твёрдые неорганические вещества, проводящие литий с помощью дефектов в кристалле, и пытаются применить их в виде электролитов для литий-ионных аккумуляторов. Такая система на первый взгляд идеальна: химическая и электрохимическая стабильность, устойчивость с повышению температуры и механическая прочность. Но у этих материалов, опять же, очень низкая ионная проводимость, и использовать их целесеобразно только в виде тонких плёнок. К тому же, работают такие материалы лучше всего при высокой температуре. И последнее, с твёрдым электролитом очень сложно создать механический контакт между электолитом и электродами (в этой области жидким электролитам нет равных).
4. Заключение.
С момента выхода в продажу литий-ионных аккумуляторов, попытки увеличить их ёмкость не прекращаются. Но в последние годы увеличение ёмкости замедлилось, несмотря на сотни новых предложенных материалов для электродов. А дело всё в том, что большинство этих новых материалов «лежат на полке» и ждут, пока не появится новый, подходящий им электролит. А разработка новых электролитов- на мой взгляд гораздо более сложная задача, чем разработка новых электродов, так как нужно учитывать не только электрохимические свойства самого электролита, но и все его взаимодействия с электродами. В общем, читая новости типа «разработан новый супер-электрод…» надо проверять, как такой электрод взаимодействует с электролитом, и есть ли для такого электрода подходящий электролит в принципе.
Источники:
- Electrochem. Soc. Interface Fall 2016 volume 25, issue 3, 79–83
- Chem. Rev., 2014, 114 (23), pp 11503–11618
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России