Наночастицы в мозге превратили тепло в свет и заставили мышей бояться
Исследователи, работающие в области оптогенетики, научились неинвазивно активировать нейроны, способные возбуждаться под действием света. Вместо оптоволокна, которое нужно вводить в мозг через отверстие в черепе, модельным животным вкалывали наночастицы, способные превращать инфракрасное излучение в излучение синего спектра, возбуждающее модифицированные нейроны. Управлять активностью нейронов и стимулировать глубокие отделы мозга, таким образом, теперь можно прямо через ткани при помощи инфракрасного лазера. Исследование опубликовано в Science.
Оптогенетика позволяет направленно управлять активностью отдельных групп нейронов, экспрессирующих каналородопсин (ChR). Этот белок начинает пропускать ток под действием синего света и вызывает деполяризацию мембраны нейрона. Так как биологические ткани не пропускают свет видимого спектра, для управления нейронами в мозг модельным животным (чаще всего мышам) приходится вводить оптоволокно.
Ученые из японского института исследования мозга RIKEN в сотрудничестве с коллегами из Национальных университетов Токио и Сингапура предложили альтернативный способ активации нейронов при помощи ап-конверсионных наночастиц. Эти наночастицы, содержащие ионы металлов из ряда лантаноидов, конвертируют несколько фотонов с большой длиной волны в один фотон с более высокой энергией, и соответственно, меньшей длиной волны. Такие наночастицы дают возможность использовать для стимуляции глубоких отделов мозга инфракрасное излучение, хорошо проникающее в ткани, а «на месте» превращающееся в видимый свет.
 Схема активации канала при помощи ап-конверсионных наночастиц. Neus Feliu et al / Science 2018
Схема активации канала при помощи ап-конверсионных наночастиц. Neus Feliu et al / Science 2018
Исследователи приготовили наночастицы с металлическим ядром и покрыли их оксидом кремния, чтобы избежать токсичного эффекта, обусловленного контактом ядра с тканями. После подтверждения безопасности присутствия наночастиц в нервной ткани, мышам ввели генетическую конструкцию, кодирующую каналородопсин, в область среднего мозга, отвечающую за синтез дофамина. Затем в ту же область мозга сделали инъекцию наночастиц, после чего на эту зону воздействовали излучением ближнего инфракрасного диапазона (980 нанометров) транскраниально (сквозь череп). Контрольный оптоволоконный датчик зафиксировал в мозге излучение нужной длины волны (соответствующей синему свету), а на физиологическом уровне исследователи наблюдали активацию дофаминовых нейронов и синтез дофамина в этой зоне.
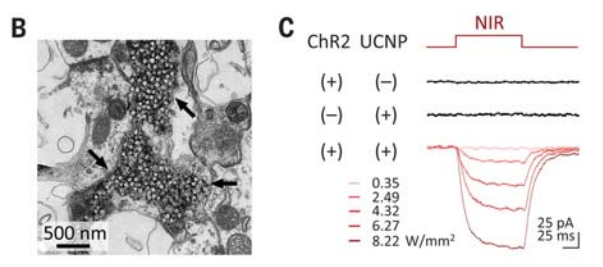
 «Беспроводная» оптогенетика подразумевает модификацию нейронов геном каналородопсина (ChR), инъекцию наночастиц (UCNP) и затем облучение ближним инфракрасным светом (NIR). Shuo Chen et al / Science 2018
«Беспроводная» оптогенетика подразумевает модификацию нейронов геном каналородопсина (ChR), инъекцию наночастиц (UCNP) и затем облучение ближним инфракрасным светом (NIR). Shuo Chen et al / Science 2018
 Наночастицы в культуре нейронов (слева) и вызванный облучением потенциал нейронов, содержащих каналородопсин, при взаимодействии с наночастицами. Shuo Chen et al / Science 2018
Наночастицы в культуре нейронов (слева) и вызванный облучением потенциал нейронов, содержащих каналородопсин, при взаимодействии с наночастицами. Shuo Chen et al / Science 2018
В следующих экспериментах при помощи наночастиц исследователи успешно синхронизировали активность нейронов в гиппокампе спящих животных и «заставили» их генерировать тета-ритм. Ученым также удалось воспроизвести более впечатляющий эксперимент на бодрствующих мышах, ранее реализованный при помощи «классической» оптогенетики. Помещая мышей в клетку, в которой их било током, ученые записали «схему» активации нейронов гиппокампа, вовлеченных в формирование плохого воспоминания и связанной с ним реакции — страха. При помощи выборочной активации этих нейронов инфракрасным излучением ученые вызывали у мышей страх даже в безопасном месте.
Конверсионные наночастицы ранее использовались для активации нейронов в клеточной культуре и на рыбках Danio **rerio. Однако на млекопитающих успешность неинвазивного подхода и возможность с его помощью даже управлять поведением животных удалось показать впервые. Теоретически неинвазивная активация отделов мозга может быть использована и на людях — к примеру, глубокая стимуляция при помощи электродов в настоящее время рассматривается как перспективное средство терапии болезни Паркинсона и большого депрессивного расстройства. Главным препятствием для введения этого метода в клинику является необходимость генетической модификации нейронов, так что пока оптогенетика во всех ее формах является уделом лабораторных животных.
В прошлом году мы рассказывали, что российские биологи предложили активировать нейроны инфракрасным излучением с использованием вместо каналородопсина термочувствительного белка змей.
Автор: Дарья Спасская
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России