Дифракция на некачественных кристаллах помогла установить структуру биомолекул
Немецкие исследователи научились устанавливать структуру биологических макромолекул на основе «некачественных» кристаллов и размытой дифракционной картины. Описание нового метода и опыта его первого применения авторы опубликовали в журнале Nature. Об их работе рассказывает и пресс–релиз синхротронного центра DESY.
Свойства и функции больших биомолекул определяются их пространственной формой, то есть структурой. Поэтому установление структуры с разрешением в несколько ангстрем, «с точностью до атома», можно считать ключевым этапом в понимании того, как макромолекула устроена и действует. Несмотря на целый ряд развитых сегодня методов, таких как ядерный магнитный резонанс, уже более полувека самым мощным из них остается рентгеноструктурный анализ. Получение белковых кристаллов и дифракция на них рентгеновских лучей позволяют установить структуру макромолекулы с разрешением, редко доступным другими путями.
 В некачественном кристалле упорядоченность расположения молекул нарушена. Иллюстрация: Ayyer K. et al., 2016
В некачественном кристалле упорядоченность расположения молекул нарушена. Иллюстрация: Ayyer K. et al., 2016
Выращивание качественных кристаллов с максимально упорядоченно расположенными молекулами белков достаточно сложный процесс. Пока невозможно точно предсказать условия, при которых та или иная макромолекула будет кристаллизоваться, и действовать приходится методом проб и ошибок, а иногда подходящие условия найти вообще не удается. Многие кристаллы получаются несовершенными и дают размытую дифракционную картину, структуру по которой можно установить лишь с невысоким разрешением.
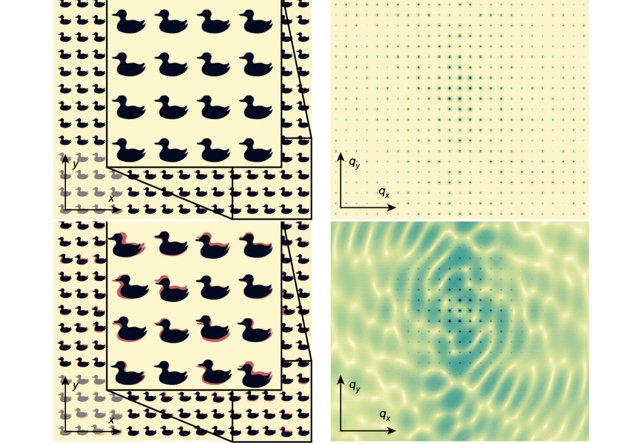 Качественный и некачественный кристаллы, и картины дифракции рентгеновских лучей на них. Иллюстрация: Ayyer K. et al., 2016
Качественный и некачественный кристаллы, и картины дифракции рентгеновских лучей на них. Иллюстрация: Ayyer K. et al., 2016
Кроме того, даже самая идеальная дифракционная картина содержит лишь информацию об амплитуде упавших на детектор волн – чем ярче пятно, тем выше пик – но не об их фазе, «отставании» одной волны от другой. Фазовая проблема в рамках классического рентгеноструктурного подхода считается нерешаемой в принципе, и часто для выяснения фазы приходится опираться на уже известную структуру похожего белка, или на отдельный ее элемент, или химически модифицировать сам белок, присоединяя к нему фрагмент с известной структурой. Лишь «наложив» эти данные на новые, удается «нащупать» фазу и приступить к расчетам структуры.
Метод, предложенный работающим в DESY профессором Генри Чэпменом (Henry Chapman), обещает решить обе описанные выше проблемы. Действительно, дифракционная картина, возникающая при рассеивании рентгеновских лучей на дефектном кристалле, в котором молекулы слегка смещены относительно упорядоченной решетчатой структуры, получается нечеткой. Лучи отклоняются на каждой молекуле слегка по-разному и не складываются в ярко выраженные пики. Эту «межпиковую» информацию можно рассматривать как шум, но Чэпмен с соавторами нашли способ использовать и ее.
Ученые указывают на предложенную еще в 1930-х формулу Паттерсона, которая позволяет рассчитать координаты атомов (электронных плотностей) в ячейке кристалла на основе лишь данных об амплитуде дифрагировавших на нем лучей, не имея информации по их фазам. Функция Паттерсона, действительно, применяется в некоторых случаях – например, для макромолекул, содержащих один тяжелый атом, наличие которого заметно влияет на дифракционную картину.
Немецкие ученые предложили рассматривать в качестве элементарной ячейки кристалла не набор упорядоченно расположенных молекул, а каждую из них по отдельности. Тогда небольшие смещения молекул друг относительно друга будут приводить к эффектам, которые описываются функцией Паттерсона. В результате размытая дифракционная картина на дефектном кристалле даст даже больше информации, чем самая идеальная дифракция.
Демонстрируя эффективность нового подхода, Чэпмен с коллегами получили кристаллы мембранного комплекса белков фотосистемы II. С помощью обычного наблюдения дифракционных пиков ученые установили его структуру с разрешением 4,5 ангстрем, а дополнение этой информации междупиковыми данными «рассеянной» дифракции позволило повысить разрешение до 3,5 ангстрем.
Автор: Роман Фишман
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России