Биспецифические антитела могут уничтожать скрытые резервуары ВИЧ-инфекции
Борьба с вирусом иммунодефицита человека (ВИЧ) не прекращается, и пока он остается нерешенной проблемой человечества. Современные методы лечения продлевают жизнь инфицированных людей практически до продолжительности жизни здоровых, но при этом они лишь подавляют репликацию вируса, не позволяя добиться полного излечения. Некоторая доля зараженных ВИЧ клеток не погибает и становится латентным (скрытым) резервуаром вируса. Ученые из США разработали специальные антитела, направляющие цитотоксичные Т-клетки на атаку латентных ВИЧ-клеток. Перспективы прямого применения этого подхода не очевидны, но полученные результаты могут оказаться важным шагом на пути разработки средств и методов полного излечения от СПИДа.
По данным Всемирной организации здравоохранения, на конец 2014 года с момента определения вируса иммунодефицита человека в 1981 году в мире заразились ВИЧ-инфекцией более 70 миллионов человек. Из них более 35 миллионов умерли, почти 37 миллионов живут инфицированными. Из-за широкого распространения и относительно быстрого роста числа зараженных ВИЧ присвоен статус пандемии (см. Epidemiology of HIV/AIDS). Особенно широко ВИЧ распространен на юге Африки (в некоторых странах этого региона, например в ЮАР и Ботсване, заражено больше 20% населения). В России, по данным на начало 2016 года, зафиксировано около миллиона ВИЧ-инфицированных, но по статистике только около половины больных знает о том, что они заражены ВИЧ, так что реальная картина может оказаться гораздо хуже.
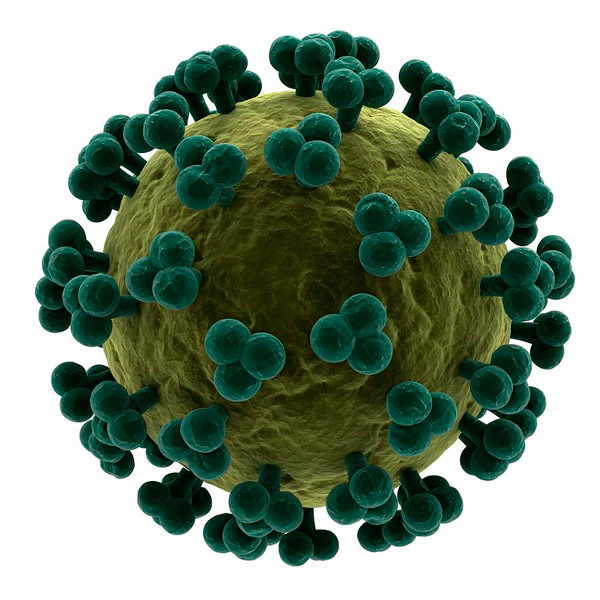 Рис. 1. Модель вируса иммунодефицита человека. Темно-зеленым цветом показаны гликопротеиновые комплексы gp120, бурым — липидная мембрана вируса. Рисунок с сайта questiongene.com
Рис. 1. Модель вируса иммунодефицита человека. Темно-зеленым цветом показаны гликопротеиновые комплексы gp120, бурым — липидная мембрана вируса. Рисунок с сайта questiongene.com
ВИЧ заражает клетки иммунной системы и перестраивает их функции под свои потребности. В результате иммунная система подавляется и развивается синдром приобретенного иммунного дефицита (СПИД). Организм больного теряет возможность защищаться от инфекций и опухолей. Без лечения человек, зараженный ВИЧ, погибает в течение 9–11 лет от так называемых оппортунистических заболеваний, с которыми здоровый организм обычно успешно справляется.
ВИЧ во внешней среде нестабилен и передается только через кровь или биологические жидкости. Заражение происходит через поврежденные кожу и слизистые оболочки или при медицинских процедурах. В цикле репродукции ВИЧ вирусная РНК с помощью вирусной обратной транскиптазы превращается в ДНК и включается в геном клетки (рис. 2). Затем она транскрибируется в РНК, которая направляет синтез вирус-специфических белков, обеспечивающих размножение вируса и формирующих вирусную частицу, которая затем отпочковывается от клетки.
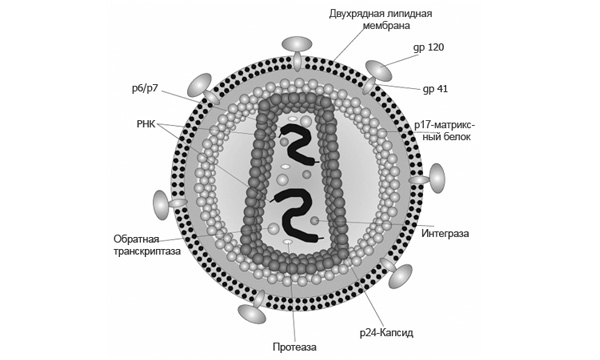 Рис. 2. Строение ВИЧ. Вирус окружен липидной мембраной, вследствие чего он нестабилен во внешней среде. В мембрану встроены поверхностные белки вируса. Антитела, использованные в обсуждаемых работах, направлены против поверхностного гликопротеина gp120. Рисунок с сайта ru.wikipedia.org
Рис. 2. Строение ВИЧ. Вирус окружен липидной мембраной, вследствие чего он нестабилен во внешней среде. В мембрану встроены поверхностные белки вируса. Антитела, использованные в обсуждаемых работах, направлены против поверхностного гликопротеина gp120. Рисунок с сайта ru.wikipedia.org
На разработку вакцин против ВИЧ были брошены значительные силы и средства, но об окончательной победе остается только мечтать. Причины неудач — в удивительной способности вируса изменять иммунологические свойства и таким образом уклоняться от действия антител, индуцированных вакциной.
Впрочем, в последние годы достигнут значительный прогресс в поддержании качества жизни больных СПИДом. Применение высокоэффективной комбинированной терапии, направленной против вирусных обратной транскриптазы и протеазы, при условии своевременного диагноза заражения позволяет продлить жизнь инфицированных людей практически до продолжительности жизни здоровых. Но некоторая доля клеток, зараженных ВИЧ (примерно одна из миллиона), не погибает и остается латентным резервуаром вируса, в котором ДНК ВИЧ интегрирована в геном, — и если противовирусную терапию прекратить, резервуар может активироваться и болезнь возобновится. Поэтому терапию приходится продолжать на протяжении всей жизни зараженного человека. Но противовирусная терапия стоит весьма дорого и может быть сопряжена с нежелательными побочными эффектами. Поэтому разработка подходов для ликвидации ВИЧ-резервуаров весьма актуальна и с медицинской, и с экономической точки зрения.
Недавно два коллектива исследователей, независимо друг от друга, практически одновременно опубликовали статьи, в которых описали оригинальный подход для ликвидации латентных ВИЧ-клеток. Обе статьи подготовлены научными коллективами из США. В обсуждаемых работах сделана попытка подойти к решению этой проблемы с помощью биспецифических антител (bi-specific antibodies).
Разработку биспецифических антител можно считать одним из наиболее важных достижений последнего времени в иммунологии и медицине, особенно в лечении онкологических заболеваний. Такой подход к лечению стали изучать в середине 80-х годов ХХ века, и довольно быстро исследования in vitro показали, что у него большой потенциал. В отличие от обычных природных антител (рис. 3), биспецифические антитела представляют собой искусственные белковые конструкции состоящие из фрагментов двух различных антител (рис. 4) и поэтому связывающиеся с двумя различными антигенами. Наиболее часто и успешно они используются для лечения рака. В этих случаях они чаще всего устроены так, что связывают цитотоксические Т-клетки (T-киллеры) иммунной системы (по их поверхностному антигену CD3) с раковыми клетками-мишенями, подлежащими уничтожению (по их поверхностному антигену).
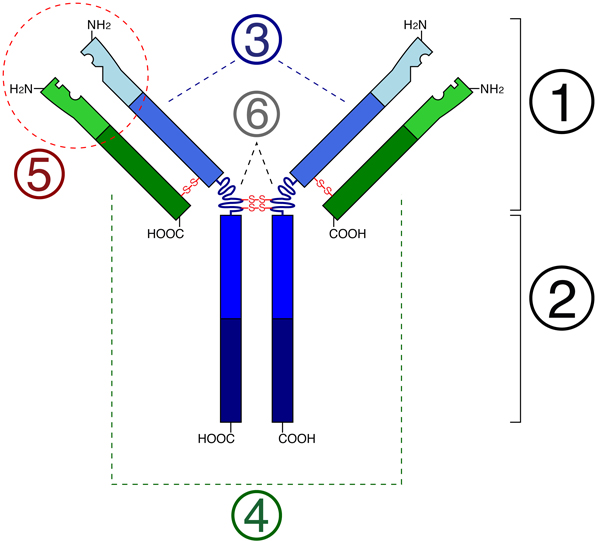 Рис. 3. Схема строения антитела. 1 — вариабельная область (Fab). 2 — консервативная область (Fс). 3 — тяжелая цепь (синяя) с вариабельным доменом (VH), соединенным с консервативным доменом (CH1), затем «шарниром» и двумя еще более консервативными доменами (CH2 и CH3). 4 — легкая цепь (зеленая) с вариабельным (VL) и консервативным (CL) доменами. 5 — сайт связывания антигена (паратоп, см. Paratope). 6 — «шарниры». Изображение с сайта en.wikipedia.org
Рис. 3. Схема строения антитела. 1 — вариабельная область (Fab). 2 — консервативная область (Fс). 3 — тяжелая цепь (синяя) с вариабельным доменом (VH), соединенным с консервативным доменом (CH1), затем «шарниром» и двумя еще более консервативными доменами (CH2 и CH3). 4 — легкая цепь (зеленая) с вариабельным (VL) и консервативным (CL) доменами. 5 — сайт связывания антигена (паратоп, см. Paratope). 6 — «шарниры». Изображение с сайта en.wikipedia.org
Первые биспецифические антитела представляли собой фактически трифункциональные антитела (см. Trifunctional antibody), созданные для поражения раковых клеток. Они состояли из двух легких и двух тяжелых белковых цепей (рис. 4). Каждая пара из них происходила из двух различных антител. Два участка связывания антигена (Fab, fragment antigen-binding) распознавали два различных антигена. Константная область Fc (кристаллизующийся фрагмент иммуноглобулина, fragment crystallizable region) образовывала третий участок связывания с антигеном, откуда и произошло название «трифункциональные антитела».
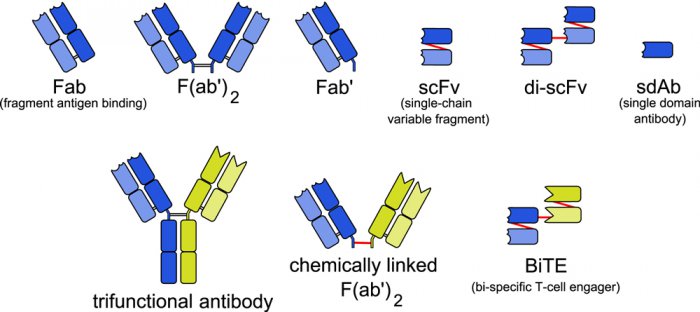 Рис. 4. Различные компоненты и конструкции биспецифических антител. Верхний ряд — различные фрагменты (домены), которые используют для конструирования биспецифических антител. Нижний ряд — три типа биспецифических антител: трифункциональные антитела, связанные химически Fab и биспецифический «мобилизатор Т-клеток». Части различных антител обозначены синим или зеленым цветом. Изображение с сайта из wikipedia.org
Рис. 4. Различные компоненты и конструкции биспецифических антител. Верхний ряд — различные фрагменты (домены), которые используют для конструирования биспецифических антител. Нижний ряд — три типа биспецифических антител: трифункциональные антитела, связанные химически Fab и биспецифический «мобилизатор Т-клеток». Части различных антител обозначены синим или зеленым цветом. Изображение с сайта из wikipedia.org
Но на пути ученых возникали трудности: биспецифические антитела непросто производить в больших количествах, а всевозможные испытания заняли много времени. К тому же применение таких антител оказалось сопряжено с рядом побочных эффектов, таких как иммуногенность (способность вызывать иммунный ответ), выделение токсичных веществ, а также короткое время существования в организме.
Чтобы решить эти проблемы позже были разработаны другие типы биспецифических антител, составленные из фрагментов антител — из химически связанных Fab, из укороченных доменов, распознающих антигены, из гибридных белков, представляющих собой соединенные между собой распознающие домены различных антител (рис. 4). Сейчас в клиническую практику введены уже несколько противораковых лекарств на основе биспецифических антител, например катумаксомаб (Catumaxomab) и блинатумомаб (Blinatumomab), разработанный на основе биспецифического «мобилизатора Т-клеток» BiTE и применяющийся против острой лимфобластной лейкемии.
Следует отметить, что впервые биспецифические антитела против клеток, продуцирующих ВИЧ, были разработаны еще 25 лет назад, но они были несовершенны, и как средство для лечения не применялись (см. J. Berg et al., 1991. Bispecific antibodies that mediate killing of cells infected with human immunodeficiency virus of any strain и А. Traunecker et al., 1991. Bispecific single chain molecules (Janusins) target cytotoxic lymphocytes on HIV infected cells). Это было в период, когда еще не были созданы эффективные противовирусные лекарства и исследователи испытывали разные пути борьбы c ВИЧ. Авторы обсуждаемых статей пошли дальше: конструкции биспецифических антител стали более совершенны, а главное, они были направлены против латентных ВИЧ-резервуаров.
Оба коллектива описывают разработку и исследование свойств биспецифических антител, в которых фрагменты антитела к поверхностному антигену ВИЧ gp120 соединены с фрагментами антитела к поверхностному антигену CD3 Т-киллеров — важнейшему компоненту клеточного иммунитета. Расчет, как в случаях противораковых антител, делается на то, что такая конструкция «подтянет» к клеткам, зараженным ВИЧ, Т-киллеры, которые будут их уничтожать (рис. 5 и рис. 6).
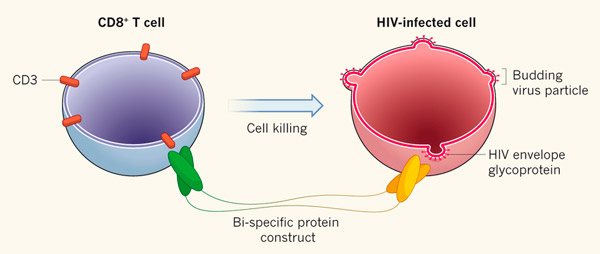 Рис. 5. Общая схема действия биспецифических антител против зараженных ВИЧ клеток. Антитела связываются с антигеном CD3 цитотоксических CD8+ Т-клеток и с поверхностным белком gp120 на мембране зараженных клеток. Таким образом, биспецифические антитела как бы «подтягивают» Т-клетки к ВИЧ-инфицированным клеткам, способствуя уничтожению последних. Рисунок из популярного синопсиса к обсуждаемым статьям
Рис. 5. Общая схема действия биспецифических антител против зараженных ВИЧ клеток. Антитела связываются с антигеном CD3 цитотоксических CD8+ Т-клеток и с поверхностным белком gp120 на мембране зараженных клеток. Таким образом, биспецифические антитела как бы «подтягивают» Т-клетки к ВИЧ-инфицированным клеткам, способствуя уничтожению последних. Рисунок из популярного синопсиса к обсуждаемым статьям
Хотя философия обоих исследований одинакова, конструкции антител в них немного отличаются (у группы A. Pegu et al. она представляется более совершенной). Дело в том, что для того, чтобы комплекс «Т-клетка + антитело» мог распознать латентные ВИЧ-резервуары, требуется спровоцировать их на продукцию поверхностных белков вируса. В работе группы J. Sung et al. это достигалось путем обработки клеток in vitro фитогемагглютинином — белком растительного происхождения, ингибитором фермента деацетилазы гистонов. В работе группы A. Pegu et al. такая «провокация» не была обязательна: их биспецифические антитела могли сами индуцировать в латентных ВИЧ-клетках продукцию поверхностных белков вируса. Было показано, что разработанные системы эффективно убивали in vitro как культивируемые латентные ВИЧ-клетки, так и зараженные клетки, полученные от больных.
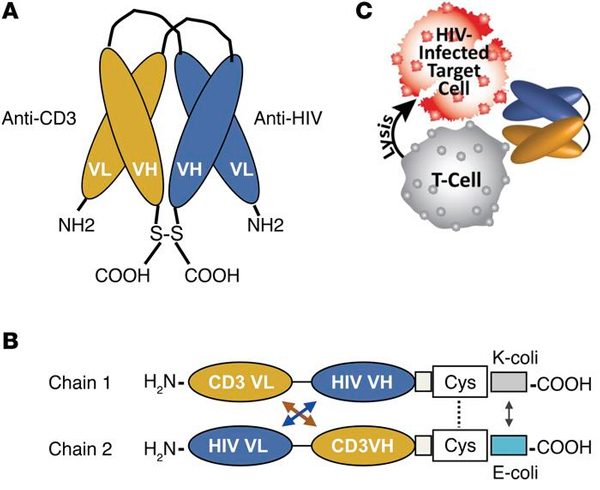 Рис. 6. А, B — схема строения искусственно сконструированных биспецифических антител к антигену CD3 цитотоксических Т-клеток и поверхностному антигену ВИЧ; вариабельный домен из тяжелой белковой цепи (VH) соединен с вариабельным доменом из легкой цепи (VL). C — схема атаки клеток, зараженных ВИЧ. Изображение из обсуждаемой статьи J. Sung et al.
Рис. 6. А, B — схема строения искусственно сконструированных биспецифических антител к антигену CD3 цитотоксических Т-клеток и поверхностному антигену ВИЧ; вариабельный домен из тяжелой белковой цепи (VH) соединен с вариабельным доменом из легкой цепи (VL). C — схема атаки клеток, зараженных ВИЧ. Изображение из обсуждаемой статьи J. Sung et al.
Авторы обеих работ полагают, что созданные ими биспецифические антитела потенциально могут стать эффективным иммунотерапевтическим средством для истребления латентных резервуаров ВИЧ. И научное сообщество, и общество в целом должны приветствовать и поддерживать исследования, направленные на полное излечение от ВИЧ. Но в данном случае перспективы клинического применения описанного подхода пока не вполне очевидны, необходимы дополнительные детальные исследования. Описанные исследования проводились in vitro, и неизвестно, в какой мере достигнутые эффекты будут иметь место в организме. Известно, что иммунотерапия с помощью чужеродных антител вызывает в организме иммунный ответ, направленный против этих антител. И такой побочный эффект действительно наблюдался группой A. Pegu et al. в опытах на обезьянах.
Агент, который бы индуцировал продукцию антигенов ВИЧ в латентно зараженных клетках, не повреждая при этом здоровые клетки, пока неизвестен. Более того, латентные резервуары ВИЧ могут находиться, например, в центральной нервной системе, куда проникновение белковых молекул затруднено из-за наличия гематоэнцефалического барьера. В общем, до применения полученных результатов пока очень далеко, и необходимо провести еще много исследований. Тем не менее, обсуждаемые работы представляются важным шагом на пути разработки средств и методов полного избавления от ВИЧ.
Источники:
- Julia A. M. Sung et al. Dual-Affinity Re-Targeting proteins direct T cell-mediated cytolysis of latently HIV-infected cells // The Journal of Clinical Investigations. 2015. V. 125. P. 4077–4090.
- Amarendra Pegu et al. Activation and lysis of human CD4 cells latently infected with HIV-1 // Nature Communications. 2015. V. 6. Article number: 8447.
- Douglas D. Richman. HIV: Cure by killing // Nature. 2015. V. 528. P. 198–199. (Популярный синопсис к обсуждаемым статьям.)
Автор: Вячеслав Калинин
- Источник(и):
- Войдите на сайт для отправки комментариев
 Сайт о нанотехнологиях #1 в России
Сайт о нанотехнологиях #1 в России